- Пресенильный психоз
-
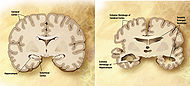
Болезнь Альцгеймера Мозг пожилого человека в норме (слева) и при патологии, вызванной болезнью Альцгеймера (справа), с указанием отличий. МКБ-10 G30., F00. МКБ-9 331.0, 290.1 OMIM 104300 DiseasesDB 490 000760 neuro/13 MeSH D000544 Болезнь Альцгеймера (также сенильная деменция альцгеймеровского типа) — наиболее распространённая форма деменции, неизлечимое дегенеративное заболевание, впервые описанное в 1906 году немецким психиатром Алоисом Альцгеймером. Как правило, она обнаруживается у людей старше 65 лет,[1] но существует и ранняя болезнь Альцгеймера — редкая форма заболевания. Общемировая заболеваемость на 2006 год оценивалась в 26.6 млн человек, а к 2050 году число больных может вырасти вчетверо.[2]
У каждого человека болезнь протекает по-своему, но при этом наблюдается ряд общих симптомов.[3] Первые заметные проявления обычно по ошибке связывают с преклонным возрастом или объясняют влиянием стресса.[4] Наиболее часто на ранних стадиях распознаётся расстройство памяти, этот симптом может проявляться, например, неспособностью вспомнить недавно заученную информацию. При обращении к врачу и подозрении на болезнь Альцгеймера, для уточнения диагноза обычно анализируют поведение, проводят серию когнитивных тестов, если возможно, проводится магнитно-резонансная томография (МРТ).[5] С развитием болезни проявляются такие симптомы как спутанность, раздражительность и агрессивность, колебания настроения, нарушается способность говорить и понимать сказанное (афазия), происходит потеря долговременной памяти и общее самоустранение больного от дел по мере затухания сознания.[4][6] Постепенная потеря функций организма ведёт к смерти.[7] Индивидуальный прогноз затруднён из-за вариаций в длительности течения болезни, которая может развиваться подспудно на протяжении длительного времени прежде чем станут заметны симптомы и будет поставлен диагноз. Средняя продолжительность жизни после установления диагноза составляет около семи лет,[8] менее трех процентов больных живут более четырнадцати лет.[9]
В настоящее время не достигнуто полного понимания причин и хода болезни Альцгеймера. Исследования говорят об ассоциации болезни с накоплением бляшек и нейрофибриллярных клубков в тканях мозга.[10] Современные методы терапии лишь несколько смягчают симптомы, но пока не позволяют ни замедлить, ни остановить развитие заболевания. Множество перспективных методов терапии достигли этапа клинических испытаний, число которых на 2008 год составляло более пятисот, однако неясно, будет ли доказана их эффективность.[11] Предлагается множество способов предупредить болезнь Альцгеймера, но не отмечено их воздействия на ход заболевания и его тяжесть. Как для предупреждения, так и для борьбы с болезнью часто рекомендуют заниматься физическими упражнениями, стимулировать мышление и придерживаться сбалансированной диеты.[12]
Уход и присмотр за пациентом крайне важен из-за неизлечимости и дегенеративного характера болезни. Эту роль часто берёт на себя супруг или близкий родственник.[13] Столь тяжёлая ноша сильно отражается на социальной, психологической, экономической и других сторонах жизни человека, занятого уходом за больным.[14][15][16] Болезнь Альцгеймера принадлежит к заболеваниям, накладывающим самый тяжелый финансовый груз на общество в развитых странах.[17][18]
Содержание
История
 Августа Д., пациентка Алоиса Альцгеймера, 1901 г.
Августа Д., пациентка Алоиса Альцгеймера, 1901 г.Врачи и философы Древней Греции и Рима связывали старость с ослаблением рассудка,[19] однако лишь в 1901 году немецкий психиатр Алоис Альцгеймер отметил случай болезни, которая впоследствии была названа его именем. Анализ заболевания пятидесятилетней Августы Д. он опубликовал впервые в 1906 году, после того как пациентка, за которой он наблюдал, скончалась.[20] В течение последующих пяти лет в медицинской литературе появилось еще одиннадцать похожих описаний, причём авторы некоторых из них уже использовали термин «болезнь Альцгеймера».[19] Эмиль Крепелин был первым, кто назвал болезнь Альцгеймера самостоятельным заболеванием. В 1910 году он выделил её в качестве подтипа сенильной деменции в восьмом издании своего учебника по психиатрии, дав ей параллельное название «пресенильная деменция».[21]
Диагноз болезни Альцгеймера на протяжении большей части двадцатого века ставили лишь относительно молодым пациентам, у которых первые симптомы деменции появились в возрасте от 45 до 65 лет. Терминология изменилась после проведённой в 1977 году конференции по болезни Альцгеймера, участники которой пришли к заключению, что клинические и патологические проявления пресенильной и сенильной деменций практически идентичны, хотя и не исключили существования этиологических различий.[22] Постепенно диагноз стали ставить независимо от возраста,[23] хотя какое-то время для описания болезни у лиц старше 65 лет всё ещё использовали термин «сенильная деменция Альцгеймерского типа» (SDAT), приберегая «классический» диагноз болезни Альцгеймера для более молодых. В итоге термин «болезнь Альцгеймера» был формально принят в медицинскую номенклатуру как название заболевания, диагностируемого независимо от возраста при наличии соответствующих симптомов, развивающихся характерным образом и сопровождающихся появлением типичных нейропатологических признаков.[24]
Эпидемиология
Заболеваемость[25]
у лиц старше 65 летВозраст Заболеваемость
(новые случаи)
на тысячу
человеко-лет65-69 3 70-74 6 75-79 9 80-84 23 85-89 40 90- 69 Два основных показателя, используемых в эпидемиологических исследованиях — заболеваемость и распространенность заболевания (болезненность). Заболеваемость отражает число новых случаев на единицу человеко-времени (обычно количество новых случаев на тысячу человеко-лет), а болезненность говорит об общем числе пораженных болезнью в популяции на конкретный момент времени.
Когортные лонгитюдные исследования (в ходе которых изначально здоровая популяция отслеживается на протяжении многих лет) говорят о заболеваемости на уровне 10-15 новых случаев на тысячу человеко-лет для всех типов деменции и 5-8 случаев для болезни Альцгеймера,[25][26] что составляет приблизительно половину от общего числа ежегодных диагнозов. Пожилой возраст является главным фактором риска, что отражается в статистике: на каждые пять лет после 65-летнего возраста показатель риска увеличивается примерно вдвое, вырастая от 3 случаев в 65 лет до 69 случаев на тысячу человеко-лет к 95 годам.[25][26] Существуют и половые различия — женщины чаще заболевают болезнью Альцгеймера, в особенности после 85 лет.[26][27]
Распространённость болезни в популяции, зависит от различных факторов, в том числе от заболеваемости и смертности. Поскольку заболеваемость растёт с возрастом, необходимо непременно учитывать средний возраст населения в исследуемой местности. В США по состоянию на 2000 год около 1.6 % населения, как в целом, так и в группе 65-74 лет, имели болезнь Альцгеймера. В группе 75-84 лет этот показатель составлял уже 19 %, а среди граждан, чей возраст превысил 84 года, распространённость болезни составляла 42 %.[28] В менее развитых странах распространённость болезни ниже.[29] По данным ВОЗ, в 2005 году деменцией страдали 0.379 % мирового населения, а прогноз на 2015 год достигает значения 0.441 % и еще больший процент населения, 0.556 %, может быть поражён болезнью к 2030 году.[30] К подобным выводам приходят и авторы других работ.[29] Еще одно исследование говорит о том, что в 2006 году распространённость болезни в мире составляла 0.40 % (разброс 0.17-0.89 %, абсолютное количество — 26.6 млн чел., с разбросом 11.4-59.4 млн) и предсказывает, что долевой показатель вырастет втрое, а абсолютное количество больных — вчетверо к 2050 году.[2]
Характеристика
Ход болезни подразделяют на четыре стадии, с прогрессирующей картиной когнитивных и функциональных нарушений.
Предеменция
Первые симптомы часто путают с проявлениями старения или реакцией на стресс.[4] Наиболее ранние когнитивные затруднения выявляются у некоторых людей при детальном нейрокогнитивном тестировании за восемь лет до постановки диагноза.[31] Эти изначальные симптомы могут отражаться на выполнении самых сложных повседневных задач.[32] Наиболее заметны расстройства памяти, проявляющиеся в затруднении при попытке вспомнить недавно заученные факты и в неспособности усвоить новую информацию.[33][34] Малозаметные проблемы исполнительных функций: сосредоточенности, планирования, когнитивной гибкости и абстрактного мышления, либо нарушение семантической памяти (память о значении слов, о взаимоотношении концепций), также могут быть симптомом ранних стадий болезни Альцгеймера.[35][36] На этой стадии может отмечаться апатия, которая остаётся самым устойчивым нейропсихиатрическим симптомом на всём протяжении заболевания.[37][38][39] Также преклиническую стадию называют «мягким когнитивным нарушением»,[40] но ведутся споры о том, использовать ли последнее название для обозначения первой ступени болезни Альцгеймера либо выделить в отдельную диагностическую единицу.[41]
Ранняя деменция
Прогрессирующее снижение памяти и агнозия при болезни Альцгеймера рано или поздно ведут к подтверждению диагноза. У небольшого числа пациентов при этом на первый план выступают не расстройства памяти, а нарушения речи, исполнительных функций, восприятия либо двигательные нарушения (апраксия).[42] Болезнь по-разному отражается на различных аспектах памяти. Старые воспоминания о собственной жизни (эпизодическая память), давно заученные факты (семантическая память), имплицитная память (неосознанная «память тела» о последовательности действий, например, о том, как использовать столовые приборы) в меньшей степени подвержены расстройству по сравнению с новыми фактами или воспоминаниями.[43][44] Афазия в основном характеризуется оскудением словарного запаса и сниженной беглостью речи, что в целом ослабляет способность к словесному и письменному выражению мыслей. На этой стадии болезни человек обычно способен адекватно оперировать простыми понятиями при речевом общении.[45][46][47] При рисовании, письме, одевании одежды и других задачах с использованием тонкой моторики, человек может казаться неловким из-за определённых проблем с координацией и планированием движений.[48] По мере развития болезни человек зачастую вполне способен выполнять многие задачи независимо, однако ему могут потребоваться помощь или присмотр при попытке провести манипуляции, требующие особенных когнитивных усилий.[42]
Умеренная деменция
Способность к независимым действиям снижается из-за прогрессирующего ухудшения состояния.[42] Расстройства речи становятся очевидными, так как с потерей доступа к словарному запасу человек все чаще подбирает неверные слова на замену забытым (парафразия). Также идет потеря навыков чтения и письма.[45][49] Со временем всё более нарушается координация при выполнении сложных последовательностей движений, что снижает способность человека справляться с большинством повседневных задач.[50] На этом этапе усиливаются проблемы с памятью, и больной может не узнавать близких родственников.[51] Прежде нетронутая долговременная память также нарушается[52] и отклонения в поведении становятся более заметными. Обычными являются такие нейропсихиатрические проявления как бродяжничество, вечернее обострение (англ. sundowning),[53] раздражительность и эмоциональная лабильность, проявляющаяся в плаче, спонтанной агрессии, или в сопротивлении уходу. Синдром ложной идентификации и другие симптомы бреда развиваются примерно у 30 % пациентов.[54][37] Может развиться недержание мочи.[55] У родственников больного и ухаживающих за ним лиц эти симптомы вызывают стресс, который может быть смягчён перемещением пациента из-под домашнего присмотра в стационарное заведение.[42][56]
Тяжелая деменция
На последней стадии болезни Альцгеймера пациент полностью зависит от посторонней помощи. Владение языком сокращается до использования единичных фраз и даже отдельных слов, и в итоге речь полностью теряется.[45] Несмотря на утрату вербальных навыков, пациенты часто способны понимать и отвечать взаимностью на эмоциональные обращения к ним.[57] Хотя на этом этапе все еще могут быть проявления агрессии, гораздо чаще состояние больного характеризуется апатией и истощением,[42] и с какого-то момента он не в состоянии осуществить даже самое простое действие без чужой помощи. Больной теряет мышечную массу, передвигается с трудом и на определенном этапе оказывается не в силах покинуть кровать,[58] а затем и самостоятельно питаться.[59] Смерть наступает обычно вследствие стороннего фактора, такого как пролежневая язва или пневмония, а не по вине собственно болезни Альцгеймера.[60][61]
Причины
Микроскопическое изображение нейрофибриллярного клубка, образованного гиперфосфорилированным тау-белком.Объяснение возможных причин заболевания предложено в трёх основных конкурирующих гипотезах. Согласно старейшей «холинергической гипотезе», на которой основано большинство существующих методов терапии, болезнь Альцгеймера вызывается сниженным синтезом нейромедиатора ацетилхолина. Поддержка этой гипотезы ослабла, поскольку медикаменты, призванные скорректировать дефицит ацетилхолина, имеют невысокую эффективность. Предполагаются иные холинергические эффекты, например, инициация крупномасштабной агрегации амилоида,[62] ведущая к генерализованному нейровоспалительному процессу.[63]
В 1991 году была предложена «амилоидная гипотеза», согласно которой базовой причиной заболевания являются отложения бета-амилоида (Aβ).[64][65] Ген, кодирующий белок (APP), из которого образуется бета-амилоид, расположен на 21 хромосоме. Интересным фактом в поддержку амилоидной гипотезы является то, что практически у всех доживших до 40 лет людей, страдающих синдромом Дауна (дополнительная копия 21 хромосомы либо ее участка), обнаруживается Альцгеймер-подобная патология.[66][67] К тому же APOE4, основной генетический фактор риска болезни Альцгеймера, приводит к избыточному накоплению амилоида в тканях мозга ещё до наступления симптомов.[68] Более того, у трансгенных мышей, в организме которых вырабатывается мутантная форма человеческого гена APP, в мозге происходит отложение фибриллярных амилоидных бляшек и отмечаются другие патологические признаки, свойственные болезни Альцгеймера.[69] Экспериментальная вакцина продемонстрировала способность очищать мозг от амилоидных бляшек в ранних испытаниях на людях, однако не оказала значительного воздействия на деменцию.[70]
Не обнаружено уверенной корреляции накопления бляшек с потерей нейронов.[71] Это говорит в поддержку тау-гипотезы, согласно которой каскад нарушений запускается отклонениями в структуре тау-белка.[65] Предположительно, нити гиперфосфорилированного тау-белка начинают объединяться между собой, образуя в итоге нейрофибриллярные клубки внутри нервных клеток.[72] Это вызывает дезинтеграцию микротрубочек и коллапс транспортной системы внутри нейрона,[73] приводя сначала к нарушению биохимической передачи сигналов между клетками, а затем и к гибели самих клеток.[74]
Патофизиология
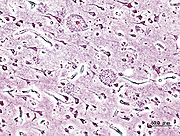 Гистопатологический образец участка коры головного мозга с сенильными бляшками. Импрегнация серебром.
Гистопатологический образец участка коры головного мозга с сенильными бляшками. Импрегнация серебром.Нейропатология
Болезнь характеризуется потерей нейронов и синаптических связей в коре головного мозга и определённых субкортикальных областях. Гибель клеток приводит к выраженной атрофии поражённых участков, в том числе к дегенерации височных и теменной долей, участков фронтальной коры и поясной извилины.[63]
Как амилоидные бляшки, так и нейрофибриллярные клубки хорошо заметны под микроскопом при посмертном анализе образцов мозга больных.[10] Бляшки представляют собой плотные, в большинстве случаев нерастворимые отложения бета-амилоида и клеточного материала внутри и снаружи нейронов. Внутри нервных клеток они растут, образуя нерастворимые закрученные сплетения волокон, часто называемые клубками. У многих пожилых людей в мозге образуется некоторое количество бляшек и клубков, однако при болезни Альцгеймера их больше в определённых участках мозга, таких как височные доли.[75]
Биохимия
 Ферменты разрезают предшественник бета-амилоида на участки, один из которых играет ключевую роль в формировании сенильных бляшек при болезни Альцгеймера.
Ферменты разрезают предшественник бета-амилоида на участки, один из которых играет ключевую роль в формировании сенильных бляшек при болезни Альцгеймера.Установлено, что болезнь Альцгеймера является протеинопатией — заболеванием, связанным с накоплением в тканях мозга ненормально свёрнутых белков — бета-амилоида и тау-белка.[76] Бляшки образуются из малых пептидов длиной в 39-43 аминокислоты, именуемых бета-амилоидом (тж. A-beta, Aβ). Бета-амилоид является фрагментом более крупного белка-предшественника — APP. Этот трансмембранный белок играет важную роль в росте нейрона, его выживании и восстановлении после повреждений.[77][78] При болезни Альцгеймера по неизвестным пока причинам APP подвергается протеолизу — разделяется на пептиды под воздействием ферментов.[79] Бета-амилоидные нити, образованные одним из пептидов, слипаются в межклеточном пространстве в плотные образования, известные как сенильные бляшки.[10][80]
 При болезни Альцгеймера изменения в структуре тау-белка приводят к дезинтеграции микротрубочек в клетках мозга.
При болезни Альцгеймера изменения в структуре тау-белка приводят к дезинтеграции микротрубочек в клетках мозга.Более специфически, болезнь Альцгеймера относят также к таупатиям — болезням, связанным с ненормальной агрегацией тау-белка. Каждый нейрон содержит цитоскелет, отчасти составленный из микротрубочек, которые действуют подобно рельсам, направляя питательные вещества и другие молекулы из центра на периферию клетки, к окончанию аксона, и обратно. Тау-белок, наряду с несколькими другими белками, ассоциирован с микротрубочками, в частности, после фосфорилирования он их стабилизирует. При болезни Альцгеймера тау-белок подвергается избыточному фосфорилированию, из-за чего нити белка начинают связываться друг с другом, слипаться в нейрофибриллярные клубки и разрушать транспортную систему нейрона.[81]
Патологический механизм
Неизвестно, как именно нарушения синтеза и последующее скопление бета-амилоидных пептидов вызывает патологические отклонения при болезни Альцгеймера.[82] Амилоидная гипотеза традиционно указывала на скопление бета-амилоида как на основное событие, запускающее процесс нейрональной дегенерации. Считается, что отложения нарушают гомеостаз ионов кальция в клетке и провоцируют апоптоз.[83] Известно, что местом скопления Aβ в нейронах пациентов являются митохондрии, также этот пептид ингибирует работу некоторых ферментов и влияет на использование глюкозы.[84]
Воспалительные процессы и цитокины могут играть роль в патофизиологии. Поскольку воспаление является признаком повреждения тканей при любом заболевании, при болезни Альцгеймера оно может играть вторичную роль по отношению к основной патологии либо представлять собой маркер иммунной реакции.[85]
Генетика
Известны три гена, мутации которых в основном позволяют объяснить происхождение редкой ранней формы, однако распространенная форма болезни Альцгеймера пока не укладывается в рамки исключительно генетической модели. Наиболее выраженным генетическим фактором риска на данный момент считается APOE, но вариации этого гена ассоциированы лишь с некоторыми случаями болезни.[86]
Менее 10 % случаев болезни в возрасте до 60 лет связаны с аутосомно-доминантными (семейными) мутациями, которые в общем массиве составляют менее 0.01 %.[86][87][88] Мутации обнаружены в генах APP, пресенилина 1 и пресенилина 2,[86] большинство из них усиливают синтез малого белка Abeta42, основного компонента сенильных бляшек.[89]
В роду большинства больных не отмечается предрасположенности к заболеванию, однако гены могут отчасти обуславливать риск. Самый известный генетический фактор риска — наследуемая аллель E4 гена APOE, с которой может быть связано до половины случаев поздней спорадической болезни Альцгеймера.[90] Генетики сходятся в мнении о том, что многие другие гены могут в какой-то степени способствовать либо препятствовать развитию поздней болезни Альцгеймера.[86] Всего на ассоциацию с этим распространенным типом болезни проверено более 400 генов.[86] Один из недавних примеров — вариация гена RELN, связанная с повышенной заболеваемостью у женщин.[91]
Диагностика
 PET-сканирование мозга при болезни Альцгеймера демонстрирует угасание активности в височных долях.
PET-сканирование мозга при болезни Альцгеймера демонстрирует угасание активности в височных долях.Клинический диагноз болезни Альцгеймера обычно основан на истории пациента (анамнезе жизни), истории его родственников и клинических наблюдений (наследственном анамнезе), при этом учитываются характерные неврологические и нейропсихологические признаки и исключаются альтернативные диагнозы.[92][93] Для того, чтобы отличить болезнь от других патологий и разновидностей деменции, могут быть использованы сложные методы медицинской визуализации — компьютерная томография, Магнитно-резонансная томография, фотонно эмиссионная компьютерная томография или Позитронно-эмиссионная томография.[94] Для более точной оценки состояния проводится тестирование интеллектуальных функций, в том числе памяти.[4] Медицинские организации вырабатывают диагностические критерии с целью облегчить диагностику практикующему врачу и стандартизировать процесс постановки диагноза. Иногда диагноз подтверждается либо устанавливается посмертно при гистологическом анализе тканей мозга.[95]
Диагностические критерии
Национальный Институт Неврологических и Коммуникативных Расстройств и Инсульта (NINDS) и Ассоциация болезни Альцгеймера составили наиболее часто используемый набор критериев для диагностики болезни Альцгеймера.[96] Согласно критериям, для постановки клинического диагноза возможной болезни Альцгеймера требуется подтвердить наличие когнитивных нарушений и предположительного синдрома деменции в ходе нейропсихологического тестирования. Для окончательного подтверждения диагноза необходим гистопатологический анализ тканей мозга, и в ходе сверки прижизненных диагнозов по критериям с посмертным анализом были отмечены хорошая статистическая надёжность и проверяемость.[97] Чаще всего нарушения при болезни Альцгеймера затрагивают восемь доменов: память, языковые навыки, способность воспринимать окружающее, конструктивные способности, ориентирование в пространстве времени собственной личности, навыки решения проблем, функционирования, самообеспечения.
Эти домены эквивалентны критериям NINCDS-ADRDA, перечисленным в DSM-IV-TR.[98][99]
Диагностические инструменты
 В диагностике болезни Альцгеймера может помочь нейропсихологическое скрининг-тестирование, при котором пациенты копируют фигуры, запоминают слова, читают, выполняют арифметические действия.
В диагностике болезни Альцгеймера может помочь нейропсихологическое скрининг-тестирование, при котором пациенты копируют фигуры, запоминают слова, читают, выполняют арифметические действия. ПЭТ-сканирование: При болезни Альцгеймера, введённый в организм Питтсбургский состав B скапливается в мозге, закрепляясь за отложения бета-амилоида (слева). Справа - мозг пожилого человека без признаков болезни Альцгеймера.
ПЭТ-сканирование: При болезни Альцгеймера, введённый в организм Питтсбургский состав B скапливается в мозге, закрепляясь за отложения бета-амилоида (слева). Справа - мозг пожилого человека без признаков болезни Альцгеймера.Нейропсихологические тесты, например, MMSE, широко применяются для оценки когнитивных нарушений, которые должны присутствовать при заболевании. Для получения надёжных результатов требуются более развёрнутые наборы тестов, особенно на ранних стадиях болезни.[100][101] В начале болезни неврологический осмотр обычно не показывает ничего необычного, за исключением явных когнитивных отклонений, которые могут напоминать обычную деменцию. Ввиду этого, для дифференциальной диагностики болезни Альцгеймера и других заболеваний важно расширенное неврологическое исследование.[4] Беседа с членами семьи также используется при оценке хода болезни, поскольку родственники могут предоставить важную информацию об уровне повседневной активности человека и о постепенном снижении его мыслительных способностей.[102] Так как сам пациент обычно не замечает нарушений, точка зрения ухаживащих за ним людей особенно важна.[103] В то же время во многих случаях ранние симптомы деменции остаются незамеченными в семье и врач получает от родственников неточную информацию.[104] Дополнительные тесты обогащают картину информацией о некоторых аспектах болезни либо позволяют исключить другие диагнозы. Анализ крови может выявить альтернативные причины деменции,[4] которые изредка даже поддаются терапии, обращающей симптомы вспять.[105] Также применяются психологические тесты для выявления депрессии, которая может как сопутствовать болезни Альцгеймера, так и являться причиной когнитивного снижения.[106][107]
Аппаратура SPECT- и PET-визуализации при её доступности может быть использована для подтверждения диагноза совместно с другими методами оценки, включающими анализ ментального статуса.[108] У людей, уже страдающих от деменции, SPECT, по некоторым данным, позволяет более эффективно дифференцировать болезнь Альцгеймера от других причин, по сравнению со стандартным тестированием и рассмотрением анамнеза.[109] Возможность наблюдать отложения бета-амилоида в мозге живых людей появилась благодаря созданию в Питтсбургском университете Питтсбургского состава B (PiB), связывающегося с амилоидными отложениями при введении в организм. Короткоживущий радиоактивный изотоп углерод-11 в соединении позволяет определять распределение этого вещества в организме и получать картину амилоидных отложений в мозге больного с помощью ПЭТ-сканера.[110] Показано также, что объективным маркером болезни может быть содержание бета-амилоида либо тау-белка в спинномозговой жидкости.[111] Эти два новых метода вызвали предложения о разработке новых диагностических критериев.[96][4]
Профилактика заболевания
 Интеллектуальная активность, в том числе увлечение игрой в шахматы, и регулярное общение коррелируют со сниженным риском развития болезни Альцгеймера, по данным эпидемиологических исследований, однако причинно-следственная связь пока не доказана.
Интеллектуальная активность, в том числе увлечение игрой в шахматы, и регулярное общение коррелируют со сниженным риском развития болезни Альцгеймера, по данным эпидемиологических исследований, однако причинно-следственная связь пока не доказана.Международные исследования, призванные оценить, насколько та или иная мера способна замедлить или предотвратить наступление болезни, нередко дают противоречивые результаты. К настоящему времени нет твердых свидетельств превентивного действия любого из рассматривавшихся факторов.[112] Вместе с тем, эпидемиологические исследования говорят о том, что некоторые поддающиеся коррекции факторы — диета, риск сердечно-сосудистых заболеваний, прием лекарств, мыслительная активность и другие — ассоциированы с вероятностью развития болезни. Однако реальные доказательства их способности предупредить болезнь могут быть получены лишь в ходе дополнительного изучения, в которое будут входить клинические исследования.[113]
Ингредиенты средиземноморской диеты, в том числе фрукты и овощи, хлеб, пшеница и другие крупяные культуры, оливковое масло, рыба и красное вино, возможно, способны по отдельности либо вкупе снижать риск и смягчать течение болезни Альцгеймера.[114] Приём некоторых витаминов, в их числе B12, B3, C и фолиевая кислота, в ходе некоторых исследований был связан со сниженным риском развития болезни,[115] однако другие работы говорят об отсутствии значимого воздействия на начало и течение болезни и о вероятности побочных эффектов.[116] Куркумин, содержащийся в распространённой специи, при исследовании на мышах показал некоторую способность предотвращать определённые патологические изменения в мозге.[117]
Факторы риска сердечно-сосудистых заболеваний, такие как высокий уровень холестерина и гипертензия, диабет, курение, ассоциированы с повышенным риском и более тяжелым течением болезни Альцгеймера,[118][119] но средства, снижающие холестерин (статины) не показали эффективности в её предотвращении либо улучшении состояния больных.[120][121] Долговременное применение нестероидных противовоспалительных средств ассоциировано со сниженной вероятностью развития болезни у некоторых людей.[122] Другие лекарства, например, гормонозаместительная терапия у женщин, более не считаются эффективными в предотвращении деменции.[123][124] Систематический обзор гинкго билоба, проведённый в 2007 году, говорит о непоследовательном и неубедительном характере представленных свидетельств воздействия препарата на когнитивные нарушения,[125] а еще одно исследование говорит об отсутствии действия на заболеваемость.[126]
Интеллектуальные занятия, такие как чтение, настольные игры, разгадывание кроссвордов, игра на музыкальных инструментах, регулярное общение, возможно, способны замедлить наступление болезни либо смягчить её развитие.[127][128] Владение двумя языками ассоциировано с более поздним началом болезни Альцгеймера.[129]
Некоторые исследования говорят о повышенном риске развития болезни Альцгеймера у тех людей, чья работа связана с воздействием магнитных полей,[130][131] попаданием в организм металлов, особенно алюминия,[132][133] или использованием растворителей.[134] Некоторые из этих публикаций подверглись критике за низкое качество работы,[135] к тому же в других исследованиях не обнаружено связи факторов внешней среды с развитием болезни Альцгеймера.[136][137][138][139]
Терапия и уход
От болезни Альцгеймера невозможно излечиться; доступные методы терапии способны в небольшой степени повлиять на симптомы, но по своей сути являются паллиативными мерами. Из всего комплекса мер можно выделить фармакологические, психосоциальные и меры по уходу за больным.
Фармакотерапия
 Трёхмерная структура донепезила, ингибитора ацетилхолинэстеразы, используемого для симптоматической терапии.
Трёхмерная структура донепезила, ингибитора ацетилхолинэстеразы, используемого для симптоматической терапии. Молекулярная структура мемантина, средства, одобренного к применению при болезни Альцгеймера.
Молекулярная структура мемантина, средства, одобренного к применению при болезни Альцгеймера.Регулирующими агентствами, такими как EMEA, в настоящее время одобрены четыре препарата для терапии когнитивных нарушений при болезни Альцгеймера — три ингибитора холинэстеразы и мемантин, NMDA-антагонист. При этом нет таких лекарств, среди действий которых было бы указано замедление либо остановка развития болезни Альцгеймера.
Известным признаком болезни Альцгеймера является снижение активности холинергических нейронов.[140] Ингибиторы холинэстеразы снижают скорость разрушения ацетилхолина (ACh), повышая его концентрацию в мозге и компенсируя потерю ACh, вызванную потерей холинергических нейронов.[141] По состоянию на 2008 год, врачами использовались такие ACh-ингибиторы как донепезил,[142] галантамин,[143] и ривастигмин (в форме таблеток[144] и пластыря[145]) Есть свидетельства эффективности этих препаратов на начальной и умеренной стадиях,[146] а также некоторые основания к их применению на поздней стадии. Только донепезил одобрен к применению при наступлении тяжелой деменции.[147] Использование этих препаратов при мягком когнитивном нарушении не замедлило наступления болезни Альцгеймера.[148] Среди побочных действий препаратов самыми распространёнными являются чувство тошноты и рвота, связанные с избытком холинергической активности, они возникают у 10-10 % пациентов и могут быть слабо- либо умеренновыраженными. Реже встречаются спазмы мышц, брадикардия, снижение аппетита, потеря веса, увеличение кислотности желудочного сока.[149]
Возбудительный нейротрансмиттер глутамат играет важную роль в работе нервной системы, но его избыток ведет к чрезмерной активации глутаматных рецепторов и может вызывать гибель клеток. Этот процесс, называемый эксайтотоксичностью, отмечается не только при болезни Альцгеймера, но и при других состояниях, например, при болезни Паркинсона и рассеянном склерозе.[150] Препарат под названием Мемантин,[151] изначально применявшийся при лечении гриппа, ингибирует активацию глутаматных NMDA-рецепторов.[150] Показана умеренная эффективность мемантина при болезни Альцгеймера умеренной и сильной тяжести, но неизвестно, как он действует на ранней стадии.[152] Редко отмечаются слабовыраженные побочные эффекты, среди них — галлюцинации, замешательство, головокружение, головная боль и утомление.[153] В комбинации с донепезилом мемантин демонстрирует «статистически значимую, но клинически едва заметную эффективность» в действии на когнитивные показатели.[154]
У пациентов, чьё поведение представляет проблему, антипсихотики могут в умеренной степени снизить агрессию и воздействовать на психоз. В тоже время эти препараты вызывают серьёзные побочные эффекты, в частности, цереброваскулярные осложнения, двигательные нарушения и снижение когнитивных способностей, что исключает их повседневное использование.[155][156] При длительном назначении антипсихотиков при болезни Альцгеймера отмечается повышенная смертность.[156]
Психосоциальное вмешательство
«Сенсорная интегративная терапия»: специальная сенсорная комната (англ. snoezelen) используется для эмоционально-ориентированной помощи людям, страдающим от деменции.Психосоциальное вмешательство дополняет фармакологическое и может быть подразделено на следующие подходы
- поведенческие
- эмоциональные
- когнитивные
- стимуляторно-ориентированные
Эффективность вмешательства пока не освещена в научной литературе, к тому же сам подход распространяется не на болезнь Альцгеймера, а на деменцию в целом.[157]
Поведенческое вмешательство нацелено на определение предпосылок и последствий проблемного поведения и работу по их коррекции. При использовании этого подхода не отмечено улучшения общего уровня функционирования,[158] но возможно смягчение некоторых отдельных проблем, таких как недержание мочи.[159]Относительно воздействия методик этого направления на другие поведенческие отклонения, такие как блуждание, не накоплено достаточно качественных данных.[160][161]
Вмешательства, затрагивающие эмоциональную сферу, включают в себя терапию воспоминаниями (reminiscence therapy, RT), валидационную терапию, поддерживающую психотерапию, сенсорную интеграцию («снузелен»), и «симуляцию присутствия» (англ. simulated presence therapy, SPT). Поддерживающая психотерапия почти не исследовалась научными методами, но некоторые клинические работники считают, что она даёт пользу при попытке помочь легкобольным пациентам адаптироваться к заболеванию.[157] При терапии воспоминаниями (RT) пациенты обсуждают пережитые ими события с глазу на глаз с терапевтом либо в группе, зачастую с использованием фотографий, предметов домашнего обихода, старых музыкальных и архивных аудиозаписей и других знакомых предметов из прошлого. Хотя число качественных исследований эффективности RT невелико, возможно положительное воздействие этого метода на мышление и настрой пациента.[162]Симуляция присутствия, основанная на теориях привязанности, подразумевает проигрывание аудиозаписей с голосами ближайших родственников. По предварительным данным, у пациентов, проходящих курс SPT, снижается уровень тревожности, поведение становится более спокойным.[163][164] Валидационная терапия основана на признании реальности и персональной правды переживаний другого человека, а на сеансах сенсорной интеграции пациент выполняет упражнения, призванные стимулировать органы чувств. Данных в поддержку этих двух методов немного.[165][166]
Ориентирование в реальности, когнитивная переподготовка и другие когнитивно-ориентированные методы терапии применяются с целью снизить когнитивный дефицит. Ориентирование в реальности заключается в представлении информации о времени, местоположении и личности пациента для того, чтобы облегчить осознание им обстановки и собственного места в ней. В свою очередь, когнитивная переподготовка проводится для улучшения нарушенных способностей больного, которому задают задачи, требующие умственного напряжения. Отмечено некоторое улучшение когнитивных возможностей при использовании как первого, так и второго метода,[167][168] однако в некоторых исследованиях этот эффект со временем исчезал и были отмечены негативные проявления, например, разочарование пациентов.[157]
Стимулирующие методы терапии включают арт-терапию, музыкотерапию, а также разновидности терапии, при которых пациенты общаются с животными, занимаются физическими упражнениями и любой другой общеукрепляющей активностью. Стимуляция, по данным исследований, в умеренной степени влияет на поведение и настроение, и еще меньше на уровень функционирования. Как бы то ни было, такая терапия проводится в основном для улучшения повседневной жизни пациентов.[157]
Уход и присмотр
- Подробное рассмотрение темы: Аспекты ухода при деменции
Поскольку болезнь Альцгеймера неизлечима и постепенно сводит на нет способности человека заботиться о себе, уход за больным фактически составляет основу терапии и заслуживает особого внимания на всём протяжении болезни.
На ранней и умеренной стадиях болезни можно повысить безопасность пациента и облегчить тяжесть ухода за ним, внося изменения в обстановку и образ жизни.[169][170] Среди таких мер — переход к простому рутинному распорядку дня, навешивание предохранительных замков, ярлыков на домашние принадлежности с пояснением, как их использовать.[171][172][157] Пациент может потерять способность самостоятельно питаться, в таком случае нужно измельчать пищу или переводить её в кашеобразное состояние.[173] При возникновении проблем с проглатыванием пищи может потребоваться кормление через трубку. В таком случае перед членами семьи и обслуживающими работниками встаёт этический вопрос о том, как долго следует продолжать кормление, насколько это эффективно с медицинской точки зрения.[174][175] Необходимость физически фиксировать пациента возникает редко на любой из стадий болезни, однако в некоторых ситуациях приходится прибегать к фиксации, чтобы уберечь больного от причинения вреда себе или окружающим.[157]
По мере развития болезни могут возникать различные осложнения, например, заболевания зубов и полости рта, пролежни, нарушения питания, гигиенические проблемы, респираторные, глазные или кожные инфекции. Их можно избежать при тщательном уходе, но при их возникновении требуется профессиональное вмешательство.[176][61] Облегчение самочувствия пациента перед приближающейся смертью становится основной задачей на последней стадии болезни.[177]
Прогноз
На ранних стадиях болезнь Альцгеймера плохо поддаётся диагностике. Определённый диагноз обычно ставится, когда когнитивные нарушения начинают отражаться на повседневной активности человека, хотя сам больной может быть еще способен жить независимой жизнью. Постепенно лёгкие проблемы в когнитивной сфере сменяются нарастающими отклонениями, как когнитивными, так и иными, и этот процесс неумолимо переводит человека в зависимое от чужой помощи состояние.[42]
Продолжительность жизни в группе больных снижена,[8][178][179] а после постановки диагноза они живут в среднем около семи лет.[8] Менее 3 % пациентов остаются в живых более четырнадцати лет.[9] С повышенной смертностью ассоциированы такие признаки, как повышенная тяжесть когнитивных нарушений, сниженный уровень функционирования, падения, отклонения при неврологическом осмотре. Другие сопутствующие нарушения, например, кардиологические проблемы, диабет, история злоупотреблений алкоголем, также связаны со сниженным выживанием.[180][178][181] Чем раньше началась болезнь Альцгеймера, тем больше лет в среднем удаётся прожить пациенту после диагноза, но при сравнении со здоровыми людьми общая продолжительность жизни такого человека особенно низка.[179] Прогноз по выживаемости у женщин более благоприятен, чем у мужчин.[9][182]
Смертность у пациентов в 70 % случаев обусловлена самой болезнью,[8] при этом чаще всего непосредственными причинами являются пневмония и дегидратация. Рак при болезни Альцгеймера отмечается реже, чем в общей популяции.[8][182]
Культура и общество
Нагрузка на общество
Среди болезней, налагающих большую нагрузку на общество в развитых странах, болезнь Альцгеймера и деменция в целом могут занимать одно из первых мест.[17][18] В развивающихся странах, таких как Аргентина,[183] и новых развитых странах (Южная Корея),[184] общественные затраты также высоки и продолжают расти. Вероятно, они поднимутся ещё выше по мере старения общества и станут важной социальной проблемой. В число затрат входят прямые медицинские расходы на содержание домов престарелых и немедицинские — на домашний уход за больным, и косвенные расходы, например, потеря производительности — как пациента, так и человека, заботящегося о нём.[18] Приводимые в исследованиях оценки разнятся, но в целом по всему миру затраты на деменцию могут составлять около 160 млрд долл.,[185] а в США — около 100 млрд долл. ежегодно.[18]
Самые большие общественные затраты идут на оплату долговременного профессионального ухода за больным, в частности, институционализацию, на это требуется до двух третей от всего объёма средств.[17] Уход на дому также обходится дорого,[17] особенно при учёте неформальных семейных расходов, в том числе уделяемого времени и потерянной заработной платы.[186]
Затраты возрастают при тяжёлой деменции и нарушениях поведения[187] в связи с необходимостью уделять больше времени на уход за больным.[186] Следовательно, любая терапия, способная замедлить угасание когнитивных способностей, отодвинуть институционализацию или уменьшить число часов, уделяемых на уход за больным, будет полезна с экономической стороны. Экономическая оценка существующих методик терапии говорит о положительных результатах.[18]
Уход за больным
- Подробное рассмотрение темы: Аспекты ухода при деменции
Основную заботу о пациенте обычно берёт на себя супруг или близкий родственник,[13] тем самым взваливая на себя тяжелую ношу, поскольку уход требует физической нагрузки, финансовых затрат, отражается на социальной стороне жизни и психологически очень тягостен.[14][15][16] И пациенты, и родственники обычно предпочитают уход на дому.[188] При этом возможно отложить либо вовсе избежать необходимости в более профессиональном и дорогостоящем уходе,[189][188] однако две трети жильцов в домах престарелых всё же страдают от деменции.[157]
Среди лиц, заботящихся о дементном больном, отмечается высокий уровень соматических заболеваний и расстройств психики.[190] Если они живут под одной крышей с больным, если больной — супруг или супруга, если больной впадает в депрессию, ведет себя неадекватно, галлюцинирует, страдает от нарушений сна и не в состоянии нормально передвигаться — все эти факторы, по данным исследований, связаны с повышенным числом психосоциальных проблем.[191][192] Заботящийся о больном также вынужден проводить с ним в среднем 47 часов в неделю, зачастую за счёт рабочего времени, при этом затраты на уход высоки. Прямые и косвенные расходы по уходу за пациентом в США составляют в среднем от 18000$ до 77500$ в год, по данным разных исследований.[193][186]
По данным исследований, психологическое здоровье лиц, заботящихся о больных, можно укрепить методами когнитивной поведенческой терапии и обучением стратегиям противодействия стрессу, как индивидуально, так и в группах.[14][194]
Известные персоны, СМИ, произведения искусства
 Чарлтон Хестон и Рональд Рейган на встрече в Белом Доме, 1981 год. Оба к концу жизни заболели болезнью Альцгеймера
Чарлтон Хестон и Рональд Рейган на встрече в Белом Доме, 1981 год. Оба к концу жизни заболели болезнью АльцгеймераБолезнь Альцгеймера поражает многих людей, не минуя знаменитостей, в том числе таких известных, как бывший президент США Рональд Рейган и ирландская писательница Айрис Мёрдок. Факт болезни обоих не только широко освещался в СМИ, но и послужил основанием для научных статей, авторы которых анализируют прогрессирующее ослабление когнитивных функций данных публичных персон.[195][196] Другими знаменитыми жертвами болезни стали футболист Ференц Пушкаш[197], бывший премьер-министр Великобритании Гарольд Вильсон, премьер-министр Испании Адольфо Суарес[198][199], актёры Рита Хейворт[200] и Чарлтон Хестон[201], писатель Терри Пратчетт[202].
Болезнь Альцгеймера также отражена в фильмах, в их числе «Айрис» (2001)[203], основанный на мемуарах Джона Бейли, мужа Айрис Мёрдок[204]; «Дневник памяти» (2004)[205] по одноименному роману Николаса Спаркса[206]; «Танматра» (2005);[207] «Память о завтрашнем дне» (2006) [208] по одноимённому роману Хироси Огивара;[209] «Далеко от неё» (2006), по рассказу Элис Манро «Медведь перешёл через гору».[210]
Среди документальных фильмов можно отметить такие работы, как «Малькольм и Барбара: история любви» (1999) и «Малькольм и Барбара: прощание любви», с участием Малькольма Пуантона.[211]
Направления исследований
В 2008 году более 400 фармацевтических препаратов находились на стадии тестирования в различных странах мира. Примерно четверть из них проходили III фазу клинических испытаний, при успешном завершении которой вопрос о применении средства рассматривается регулирующими органами.[212]
Существует направление клинических исследований, нацеленное на коррекцию базовых патологических изменений. Одной из типичных мишеней для препаратов, проходящих тестирование, являются скопления бета-амилоида, которые необходимо сократить. Испытываются такие методы, как иммунотерапия или вакцинация против амилоидного белка. В отличие от обычной вакцинации, осуществляемой заранее, в случае болезни Альцгеймера вакцина будет вводиться пациентам, уже получившим диагноз. Согласно концепции исследователей, иммунная система больного должна научиться распознавать и атаковать отложения амилоида, уменьшая их размеры и облегчая течение болезни.[213] В качестве конкретного примера вакцины можно привести молекулу ACC-001,[214][215] клинические испытания которой были заморожены в 2008 году.[216] Другое подобное средство — бапинейзумаб, искусственное антитело, идентичное натуральному анти-амилоидному антителу.[217] Также в разработке находятся нейропротекторные средства, например, AL-108,[218] и ингибиторы металло-белковых взаимодействий, такие как PBT2.[219] Гибридный белок этанерцепт, действующий как TNF-ингибитор, демонстрирует обнадёживающие результаты.[220]
В ходе клинических испытаний, проведённых в 2008 году, у пациентов на начальной и умеренной стадиях были отмечены позитивные сдвиги в течении болезни под воздействием тетраметилтионина хлорида, ингибирующего агрегацию тау-белка,[221][222] и антигистамина димебона.[223]
Чтобы обеспечить учёным разных стран возможность обмениваться идеями и предлагать гипотезы, а также предоставить всем интересующимся сведения о новейших научных исследованиях, был создан онлайн-проект Alzheimer Research Forum.
Примечания
- ↑ Brookmeyer R, Gray S, Kawas C (September 1998). "Projections of Alzheimer's disease in the United States and the public health impact of delaying disease onset". Am J Public Health 88 (9): 1337–42. PMID 9736873.
- ↑ 1 2 2006 prevalence estimate:
- Brookmeyer R, Johnson E, Ziegler-Graham K, MH Arrighi (July 2007). "Forecasting the global burden of Alzheimer’s disease". Alzheimer's and Dementia 3 (3): 186–91. DOI:10.1016/j.jalz.2007.04.381. Проверено 2008-06-18.
- (2007). "World population prospects: the 2006 revision, highlights" (PDF). Working Paper No. ESA/P/WP.202. Population Division, Department of Economic and Social Affairs, United Nations. Проверено 27 августа 2008.
- ↑ What is Alzheimer’s disease?. Alzheimers.org.uk (August 2007). Проверено 21 февраля 2008.
- ↑ 1 2 3 4 5 6 7 Waldemar G, Dubois B, Emre M, et al (January 2007). "Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline". Eur. J. Neurol. 14 (1): e1–26. DOI:10.1111/j.1468-1331.2006.01605.x. PMID 17222085.
- ↑ Alzheimer's diagnosis of AD. Alzheimer's Research Trust. Проверено 29 февраля 2008.
- ↑ Tabert MH, Liu X, Doty RL, Serby M, Zamora D, Pelton GH, Marder K, Albers MW, Stern Y, Devanand DP (2005). "A 10-item smell identification scale related to risk for Alzheimer's disease". Ann. Neurol. 58 (1): 155–160. DOI:10.1002/ana.20533. PMID 15984022.
- ↑ Understanding stages and symptoms of Alzheimer's disease. National Institute on Aging (2007-10-26). Проверено 21 февраля 2008.
- ↑ 1 2 3 4 5 Mölsä PK, Marttila RJ, Rinne UK (August 1986). "Survival and cause of death in Alzheimer's disease and multi-infarct dementia". Acta Neurol. Scand. 74 (2): 103–7. PMID 3776457. Проверено 2008-08-04.
- ↑ 1 2 3 Mölsä PK, Marttila RJ, Rinne UK (March 1995). "Long-term survival and predictors of mortality in Alzheimer's disease and multi-infarct dementia". Acta Neurol. Scand. 91 (3): 159–64. PMID 7793228.
- ↑ 1 2 3 Tiraboschi P, Hansen LA, Thal LJ, Corey-Bloom J (June 2004). "The importance of neuritic plaques and tangles to the development and evolution of AD". Neurology 62 (11): 1984–9. PMID 15184601.
- ↑ Alzheimer's Disease Clinical Trials. US National Institutes of Health. Проверено 18 августа 2008.
- ↑ Can Alzheimer's disease be prevented (pdf). National Institute on Aging (2006-08-29). Проверено 29 февраля 2008.
- ↑ 1 2 The MetLife study of Alzheimer’s disease: The caregiving experience (PDF). MetLife Mature Market Institute (August 2006). Проверено 12 февраля 2008.
- ↑ 1 2 3 Thompson CA, Spilsbury K, Hall J, Birks Y, Barnes C, Adamson J (2007). "Systematic review of information and support interventions for caregivers of people with dementia". BMC Geriatr 7: 18. DOI:10.1186/1471-2318-7-18. PMID 17662119.
- ↑ 1 2 Schneider J, Murray J, Banerjee S, Mann A (August 1999). "EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: I—Factors associated with carer burden". International Journal of Geriatric Psychiatry 14 (8): 651–661. DOI:<651::AID-GPS992>3.0.CO;2-B 10.1002/(SICI)1099-1166(199908)14:8<651::AID-GPS992>3.0.CO;2-B. PMID 10489656. Проверено 2008-07-04.
- ↑ 1 2 Murray J, Schneider J, Banerjee S, Mann A (August 1999). "EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: II--A qualitative analysis of the experience of caregiving". International Journal of Geriatric Psychiatry 14 (8): 662–667. DOI:<662::AID-GPS993>3.0.CO;2-4 10.1002/(SICI)1099-1166(199908)14:8<662::AID-GPS993>3.0.CO;2-4. PMID 10489657.
- ↑ 1 2 3 4 Bonin-Guillaume S, Zekry D, Giacobini E, Gold G, Michel JP (January 2005). "Impact économique de la démence (English: The economical impact of dementia)" (in French). Presse Med 34 (1): 35–41. ISSN 0755-4982. PMID 15685097.
- ↑ 1 2 3 4 5 Meek PD, McKeithan K, Schumock GT (1998). "Economic considerations in Alzheimer's disease". Pharmacotherapy 18 (2 Pt 2): 68–73; discussion 79–82. PMID 9543467.
- ↑ 1 2 Berchtold NC, Cotman CW (1998). "Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s". Neurobiol. Aging 19 (3): 173–89. PMID 9661992.
- ↑ Auguste D.:
- Alzheimer Alois (1907). "Über eine eigenartige Erkrankung der Hirnrinde [About a peculiar disease of the cerebral cortex]" (in (нем.)). Allgemeine Zeitschrift fur Psychiatrie und Psychisch-Gerichtlich Medizin 64 (1–2): 146–148.
- Alzheimer Alois (1987). "About a peculiar disease of the cerebral cortex. By Alois Alzheimer, 1907 (Translated by L. Jarvik and H. Greenson)". Alzheimer Dis Assoc Disord 1 (1): 3–8. PMID 3331112.
- Alzheimer: the life of a physician and the career of a disease. — New York: Columbia University Press, 2003. — С. 270. — ISBN 0-231-11896-1
- ↑ Clinical Psychiatry: A Textbook For Students And Physicians (Reprint). — Kessinger Publishing. — С. 568. — ISBN 1-4325-0833-4
- ↑ Alzheimer's disease: senile dementia and related disorders. — New York: Raven Press, 1978. — С. 595. — ISBN 0-89004-225-X
- ↑ Boller F, Forbes MM (June 1998). "History of dementia and dementia in history: an overview". J. Neurol. Sci. 158 (2): 125–33. PMID 9702682.
- ↑ Amaducci LA, Rocca WA, Schoenberg BS (November 1986). "Origin of the distinction between Alzheimer's disease and senile dementia: how history can clarify nosology". Neurology 36 (11): 1497–9. PMID 3531918.
- ↑ 1 2 3 Bermejo-Pareja F, Benito-León J, Vega S, Medrano MJ, Román GC (January 2008). "Incidence and subtypes of dementia in three elderly populations of central Spain". J. Neurol. Sci. 264 (1–2): 63–72. DOI:10.1016/j.jns.2007.07.021. PMID 17727890.
- ↑ 1 2 3 Di Carlo A, Baldereschi M, Amaducci L, et al (January 2002). "Incidence of dementia, Alzheimer's disease, and vascular dementia in Italy. The ILSA Study". J Am Geriatr Soc 50 (1): 41–8. PMID 12028245.
- ↑ Andersen K, Launer LJ, Dewey ME, et al (December 1999). "Gender differences in the incidence of AD and vascular dementia: The EURODEM Studies. EURODEM Incidence Research Group". Neurology 53 (9): 1992–7. PMID 10599770.
- ↑ 2000 U.S. estimates:
- Hebert LE, Scherr PA, Bienias JL, Bennett DA, Evans DA (August 2003). "Alzheimer disease in the US population: prevalence estimates using the 2000 census". Arch. Neurol. 60 (8): 1119–22. DOI:10.1001/archneur.60.8.1119. PMID 12925369.
- Profiles of general demographic characteristics, 2000 census of population and housing, United States (PDF). U.S. Census Bureau (Бюро переписи США) (2001). Проверено 27 августа 2008.
- ↑ 1 2 Ferri CP, Prince M, Brayne C, et al (December 2005). "Global prevalence of dementia: a Delphi consensus study" (PDF). Lancet 366 (9503): 2112–7. DOI:10.1016/S0140-6736(05)67889-0. PMID 16360788. Проверено 2008-06-13.
- ↑ World Health Organization Neurological Disorders: Public Health Challenges. — Switzerland: World Health Organization, 2006. — С. 204–207. — ISBN 978-92-4-156336-9
- ↑ Preclinical: *Linn RT, Wolf PA, Bachman DL, et al (May 1995). "The 'preclinical phase' of probable Alzheimer's disease. A 13-year prospective study of the Framingham cohort". Arch. Neurol. 52 (5): 485–90. PMID 7733843. Проверено 2008-08-04.
- Saxton J, Lopez OL, Ratcliff G, et al (December 2004). "Preclinical Alzheimer disease: neuropsychological test performance 1.5 to 8 years prior to onset". Neurology 63 (12): 2341–7. PMID 15623697.
- Twamley EW, Ropacki SA, Bondi MW (September 2006). "Neuropsychological and neuroimaging changes in preclinical Alzheimer's disease". J Int Neuropsychol Soc 12 (5): 707–35. DOI:10.1017/S1355617706060863. PMID 16961952.
- ↑ Perneczky R, Pohl C, Sorg C, Hartmann J, Komossa K, Alexopoulos P, Wagenpfeil S, Kurz A (2006). "Complex activities of daily living in mild cognitive impairment: conceptual and diagnostic issues". Age Ageing 35 (3): 240–245. DOI:10.1093/ageing/afj054. PMID 16513677.
- ↑ Arnáiz E, Almkvist O (2003). "Neuropsychological features of mild cognitive impairment and preclinical Alzheimer's disease". Acta Neurol. Scand., Suppl. 179: 34–41. DOI:10.1034/j.1600-0404.107.s179.7.x. PMID 12603249. Проверено 2008-06-12.
- ↑ Kazui H, Matsuda A, Hirono N, et al (2005). "Everyday memory impairment of patients with mild cognitive impairment". Dement Geriatr Cogn Disord 19 (5–6): 331–7. DOI:10.1159/000084559. PMID 15785034. Проверено 2008-06-12.
- ↑ Rapp MA, Reischies FM (2005). "Attention and executive control predict Alzheimer disease in late life: results from the Berlin Aging Study (BASE)". American Journal of Geriatric Psychiatry 13 (2): 134–141. DOI:10.1176/appi.ajgp.13.2.134. PMID 15703322.
- ↑ Spaan PE, Raaijmakers JG, Jonker C (2003). "Alzheimer's disease versus normal ageing: a review of the efficiency of clinical and experimental memory measures". Journal of Clinical Experimental Neuropsychology 25 (2): 216–233. PMID 12754679.
- ↑ 1 2 Craig D, Mirakhur A, Hart DJ, McIlroy SP, Passmore AP (2005). "A cross-sectional study of neuropsychiatric symptoms in 435 patients with Alzheimer's disease". American Journal of Geriatric Psychiatry 13 (6): 460–468. DOI:10.1176/appi.ajgp.13.6.460. PMID 15956265.
- ↑ Robert PH, Berr C, Volteau M, Bertogliati C, Benoit M, Sarazin M, Legrain S, Dubois B (2006). "Apathy in patients with mild cognitive impairment and the risk of developing dementia of Alzheimer's disease: a one-year follow-up study". Clin Neurol Neurosurg 108 (8): 733–736. DOI:10.1016/j.clineuro.2006.02.003. PMID 16567037.
- ↑ Palmer K, Berger AK, Monastero R, Winblad B, Bäckman L, Fratiglioni L (2007). "Predictors of progression from mild cognitive impairment to Alzheimer disease". Neurology 68 (19): 1596–1602. DOI:10.1212/01.wnl.0000260968.92345.3f. PMID 17485646.
- ↑ Small BJ, Gagnon E, Robinson B (April 2007). "Early identification of cognitive deficits: preclinical Alzheimer's disease and mild cognitive impairment". Geriatrics 62 (4): 19–23. PMID 17408315.
- ↑ Petersen RC (February 2007). "The current status of mild cognitive impairment—what do we tell our patients?". Nat Clin Pract Neurol 3 (2): 60–1. DOI:10.1038/ncpneuro0402. PMID 17279076.
- ↑ 1 2 3 4 5 6 Förstl H, Kurz A (1999). "Clinical features of Alzheimer's disease". European Archives of Psychiatry and Clinical Neuroscience 249 (6): 288–290. PMID 10653284.
- ↑ Carlesimo GA, Oscar-Berman M (June 1992). "Memory deficits in Alzheimer's patients: a comprehensive review". Neuropsychol Rev 3 (2): 119–69. PMID 1300219.
- ↑ Jelicic M, Bonebakker AE, Bonke B (1995). "Implicit memory performance of patients with Alzheimer's disease: a brief review". International Psychogeriatrics 7 (3): 385–392. DOI:10.1017/S1041610295002134. PMID 8821346.
- ↑ 1 2 3 Frank EM (September 1994). "Effect of Alzheimer's disease on communication function". J S C Med Assoc 90 (9): 417–23. PMID 7967534.
- ↑ Becker JT, Overman AA (2002). "[The semantic memory deficit in Alzheimer's disease]" (in Spanish; Castilian). Rev Neurol 35 (8): 777–83. PMID 12402233.
- ↑ Hodges JR, Patterson K (April 1995). "Is semantic memory consistently impaired early in the course of Alzheimer's disease? Neuroanatomical and diagnostic implications". Neuropsychologia 33 (4): 441–59. PMID 7617154.
- ↑ Benke T (December 1993). "Two forms of apraxia in Alzheimer's disease". Cortex 29 (4): 715–25. PMID 8124945.
- ↑ Forbes KE, Shanks MF, Venneri A (March 2004). "The evolution of dysgraphia in Alzheimer's disease". Brain Res. Bull. 63 (1): 19–24. DOI:10.1016/j.brainresbull.2003.11.005. PMID 15121235.
- ↑ Galasko D, Schmitt F, Thomas R, Jin S, Bennett D (2005). "Detailed assessment of activities of daily living in moderate to severe Alzheimer's disease". Journal of the International Neuropsychology Society 11 (4): 446–453. PMID 16209425.
- ↑ Galasko D, Schmitt F, Thomas R, Jin S, Bennett D (July 2005). "Detailed assessment of activities of daily living in moderate to severe Alzheimer's disease". J Int Neuropsychol Soc 11 (4): 446–53. PMID 16209425.
- ↑ Sartori G, Snitz BE, Sorcinelli L, Daum I (September 2004). "Remote memory in advanced Alzheimer's disease". Arch Clin Neuropsychol 19 (6): 779–89. DOI:10.1016/j.acn.2003.09.007. PMID 15288331.
- ↑ Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A (May 2001). "Sundowning and circadian rhythms in Alzheimer's disease". Am J Psychiatry 158 (5): 704–11. PMID 11329390. Проверено 2008-08-27.
- ↑ Neuropsychiatric symptoms: *Scarmeas N, Brandt J, Blacker D, et al (December 2007). "Disruptive behavior as a predictor in Alzheimer disease". Arch. Neurol. 64 (12): 1755–61. DOI:10.1001/archneur.64.12.1755. PMID 18071039. *Tatsch MF, Bottino CM, Azevedo D, et al (May 2006). "Neuropsychiatric symptoms in Alzheimer disease and cognitively impaired, nondemented elderly from a community-based sample in Brazil: prevalence and relationship with dementia severity". Am J Geriatr Psychiatry 14 (5): 438–45. DOI:10.1097/01.JGP.0000218218.47279.db. PMID 16670248. *Volicer L, Bass EA, Luther SL (October 2007). "Agitation and resistiveness to care are two separate behavioral syndromes of dementia". J Am Med Dir Assoc 8 (8): 527–32. DOI:10.1016/j.jamda.2007.05.005. PMID 17931577.
- ↑ Honig LS, Mayeux R (June 2001). "Natural history of Alzheimer's disease". Aging (Milano) 13 (3): 171–82. PMID 11442300.
- ↑ Gold DP, Reis MF, Markiewicz D, Andres D (January 1995). "When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia". J Am Geriatr Soc 43 (1): 10–6. PMID 7806732.
- ↑ Bär M, Kruse A, Re S (December 2003). "[Situations of emotional significance in residents suffering from dementia]" (in German). Z Gerontol Geriatr 36 (6): 454–62. DOI:10.1007/s00391-003-0191-0. PMID 14685735.
- ↑ Souren LE, Franssen EH, Reisberg B (June 1995). "Contractures and loss of function in patients with Alzheimer's disease". J Am Geriatr Soc 43 (6): 650–5. PMID 7775724.
- ↑ Berkhout AM, Cools HJ, van Houwelingen HC (September 1998). "The relationship between difficulties in feeding oneself and loss of weight in nursing-home patients with dementia". Age Ageing 27 (5): 637–41. PMID 12675103.
- ↑ Wada H, Nakajoh K, Satoh-Nakagawa T, et al (2001). "Risk factors of aspiration pneumonia in Alzheimer's disease patients". Gerontology 47 (5): 271–6. PMID 11490146.
- ↑ 1 2 Gambassi G, Landi F, Lapane KL, Sgadari A, Mor V, Bernabei R (July 1999). "Predictors of mortality in patients with Alzheimer's disease living in nursing homes". J. Neurol. Neurosurg. Psychiatr. 67 (1): 59–65. PMID 10369823.
- ↑ Shen ZX (2004). "Brain cholinesterases: II. The molecular and cellular basis of Alzheimer's disease". Med. Hypotheses 63 (2): 308–21. DOI:10.1016/j.mehy.2004.02.031. PMID 15236795.
- ↑ 1 2 Wenk GL (2003). "Neuropathologic changes in Alzheimer's disease". J Clin Psychiatry 64 Suppl 9: 7–10. PMID 12934968.
- ↑ Hardy J, Allsop D (October 1991). "Amyloid deposition as the central event in the aetiology of Alzheimer's disease". Trends Pharmacol. Sci. 12 (10): 383–88. PMID 1763432.
- ↑ 1 2 Mudher A, Lovestone S (January 2002). "Alzheimer's disease-do tauists and baptists finally shake hands?". Trends Neurosci. 25 (1): 22–26. PMID 11801334.
- ↑ Nistor M, Don M, Parekh M, et al (October 2007). "Alpha- and beta-secretase activity as a function of age and beta-amyloid in Down syndrome and normal brain". Neurobiol. Aging 28 (10): 1493–1506. DOI:10.1016/j.neurobiolaging.2006.06.023. PMID 16904243.
- ↑ Lott IT, Head E (March 2005). "Alzheimer disease and Down syndrome: factors in pathogenesis". Neurobiol. Aging 26 (3): 383–89. DOI:10.1016/j.neurobiolaging.2004.08.005. PMID 15639317.
- ↑ Polvikoski T, Sulkava R, Haltia M, et al (November 1995). "Apolipoprotein E, dementia, and cortical deposition of beta-amyloid protein". N. Engl. J. Med. 333 (19): 1242–47. PMID 7566000.
- ↑ Transgenic mice:
- Games D, Adams D, Alessandrini R, et al (February 1995). "Alzheimer-type neuropathology in transgenic mice overexpressing V717F beta-amyloid precursor protein". Nature 373 (6514): 523–27. DOI:10.1038/373523a0. PMID 7845465.
- Masliah E, Sisk A, Mallory M, Mucke L, Schenk D, Games D (September 1996). "Comparison of neurodegenerative pathology in transgenic mice overexpressing V717F beta-amyloid precursor protein and Alzheimer's disease". J. Neurosci. 16 (18): 5795–811. PMID 8795633. *Hsiao K, Chapman P, Nilsen S, et al (October 1996). "Correlative memory deficits, Abeta elevation, and amyloid plaques in transgenic mice". Science (journal) 274 (5284): 99–102. PMID 8810256.
- ↑ Holmes C, Boche D, Wilkinson D, et al (July 2008). "Long-term effects of Abeta42 immunisation in Alzheimer's disease: follow-up of a randomised, placebo-controlled phase I trial". Lancet 372 (9634): 216–23. DOI:10.1016/S0140-6736(08)61075-2. PMID 18640458.
- ↑ Schmitz C, Rutten BP, Pielen A, et al (April 2004). "Hippocampal neuron loss exceeds amyloid plaque load in a transgenic mouse model of Alzheimer's disease". Am. J. Pathol. 164 (4): 1495–1502. PMID 15039236.
- ↑ Goedert M, Spillantini MG, Crowther RA (July 1991). "Tau proteins and neurofibrillary degeneration". Brain Pathol. 1 (4): 279–86. PMID 1669718.
- ↑ Iqbal K, Alonso Adel C, Chen S, et al (January 2005). "Tau pathology in Alzheimer disease and other tauopathies". Biochim. Biophys. Acta 1739 (2-3): 198–210. DOI:10.1016/j.bbadis.2004.09.008. PMID 15615638.
- ↑ Chun W, Johnson GV (2007). "The role of tau phosphorylation and cleavage in neuronal cell death". Front. Biosci. 12: 733–56. PMID 17127334.
- ↑ Bouras C, Hof PR, Giannakopoulos P, Michel JP, Morrison JH (1994). "Regional distribution of neurofibrillary tangles and senile plaques in the cerebral cortex of elderly patients: a quantitative evaluation of a one-year autopsy population from a geriatric hospital". Cereb. Cortex 4 (2): 138–50. PMID 8038565.
- ↑ Hashimoto M, Rockenstein E, Crews L, Masliah E (2003). "Role of protein aggregation in mitochondrial dysfunction and neurodegeneration in Alzheimer's and Parkinson's diseases". Neuromolecular Med. 4 (1–2): 21–36. DOI:10.1385/NMM:4:1-2:21. PMID 14528050.
- ↑ Priller C, Bauer T, Mitteregger G, Krebs B, Kretzschmar HA, Herms J (July 2006). "Synapse formation and function is modulated by the amyloid precursor protein". J. Neurosci. 26 (27): 7212–21. DOI:10.1523/JNEUROSCI.1450-06.2006. PMID 16822978.
- ↑ Turner PR, O'Connor K, Tate WP, Abraham WC (May 2003). "Roles of amyloid precursor protein and its fragments in regulating neural activity, plasticity and memory". Prog. Neurobiol. 70 (1): 1–32. PMID 12927332.
- ↑ Hooper NM (April 2005). "Roles of proteolysis and lipid rafts in the processing of the amyloid precursor protein and prion protein". Biochem. Soc. Trans. 33 (Pt 2): 335–8. DOI:10.1042/BST0330335. PMID 15787600.
- ↑ Ohnishi S, Takano K (March 2004). "Amyloid fibrils from the viewpoint of protein folding". Cell. Mol. Life Sci. 61 (5): 511–24. DOI:10.1007/s00018-003-3264-8. PMID 15004691.
- ↑ Hernández F, Avila J (September 2007). "Tauopathies". Cell. Mol. Life Sci. 64 (17): 2219–33. DOI:10.1007/s00018-007-7220-x. PMID 17604998.
- ↑ Van Broeck B, Van Broeckhoven C, Kumar-Singh S (2007). "Current insights into molecular mechanisms of Alzheimer disease and their implications for therapeutic approaches". Neurodegener Dis 4 (5): 349–65. DOI:10.1159/000105156. PMID 17622778.
- ↑ Yankner BA, Duffy LK, Kirschner DA (October 1990). "Neurotrophic and neurotoxic effects of amyloid beta protein: reversal by tachykinin neuropeptides". Science (journal) 250 (4978): 279–82. PMID 2218531.
- ↑ Chen X, Yan SD (December 2006). "Mitochondrial Abeta: a potential cause of metabolic dysfunction in Alzheimer's disease". IUBMB Life 58 (12): 686–94. DOI:10.1080/15216540601047767. PMID 17424907.
- ↑ Greig NH, Mattson MP, Perry T, et al (December 2004). "New therapeutic strategies and drug candidates for neurodegenerative diseases: p53 and TNF-alpha inhibitors, and GLP-1 receptor agonists". Ann. N. Y. Acad. Sci. 1035: 290–315. DOI:10.1196/annals.1332.018. PMID 15681814.
- ↑ 1 2 3 4 5 Waring SC, Rosenberg RN (March 2008). "Genome-wide association studies in Alzheimer disease". Arch. Neurol. 65 (3): 329–34. DOI:10.1001/archneur.65.3.329. PMID 18332245.
- ↑ Hoenicka J (2006 March 1–15). "Genes in Alzheimer's disease". Rev Neurol 42 (5): 302–05. PMID 16538594.
- ↑ Campion D, Dumanchin C, Hannequin D, et al (September 1999). "Early-onset autosomal dominant Alzheimer disease: prevalence, genetic heterogeneity, and mutation spectrum". Am. J. Hum. Genet. 65 (3): 664–70. DOI:10.1086/302553. PMID 10441572.
- ↑ Selkoe DJ (June 1999). "Translating cell biology into therapeutic advances in Alzheimer's disease". Nature 399 (6738 Suppl): A23–31. PMID 10392577.
- ↑ Strittmatter WJ, Saunders AM, Schmechel D, et al (March 1993). "Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease". Proc. Natl. Acad. Sci. USA 90 (5): 1977–81. PMID 8446617.
- ↑ Seripa D, Matera MG, Franceschi M, et al (July 2008). "The RELN locus in Alzheimer's disease". J Alzheimers Dis. 14 (3): 335–44. PMID 18599960.
- ↑ Mendez MF (2006). "The accurate diagnosis of early-onset dementia". International Journal of Psychiatry Medicine 36 (4): 401–412. PMID 17407994.
- ↑ Klafki HW, Staufenbiel M, Kornhuber J, Wiltfang J (November 2006). "Therapeutic approaches to Alzheimer's disease". Brain 129 (Pt 11): 2840–55. DOI:10.1093/brain/awl280. PMID 17018549.
- ↑ Dementia: Quick reference guide (PDF). London: (UK) National Institute for Health and Clinical Excellence (November 2006). Проверено 22 февраля 2008.
- ↑ McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM (July 1984). "Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease". Neurology 34 (7): 939–44. PMID 6610841.
- ↑ 1 2 Dubois B, Feldman HH, Jacova C, et al (August 2007). "Research criteria for the diagnosis of Alzheimer's disease: revising the NINCDS-ADRDA criteria". Lancet Neurol 6 (8): 734–46. DOI:10.1016/S1474-4422(07)70178-3. PMID 17616482.
- ↑ Blacker D, Albert MS, Bassett SS, Go RC, Harrell LE, Folstein MF (December 1994). "Reliability and validity of NINCDS-ADRDA criteria for Alzheimer's disease. The National Institute of Mental Health Genetics Initiative". Arch. Neurol. 51 (12): 1198–204. PMID 7986174.
- ↑ American Psychiatric Association Diagnostic and statistical manual of mental disorders: DSM-IV-TR. — 4th Edition Text Revision. — Washington DC: American Psychiatric Association, 2000. — ISBN 0890420254
- ↑ Ito N (May 1996). "[Clinical aspects of dementia]" (in Japanese). Hokkaido Igaku Zasshi 71 (3): 315–20. PMID 8752526.
- ↑ Tombaugh TN, McIntyre NJ (September 1992). "The mini-mental state examination: a comprehensive review". J Am Geriatr Soc 40 (9): 922–35. PMID 1512391.
- ↑ Pasquier F (January 1999). "Early diagnosis of dementia: neuropsychology". J. Neurol. 246 (1): 6–15. PMID 9987708.
- ↑ Harvey PD, Moriarty PJ, Kleinman L, et al (2005). "The validation of a caregiver assessment of dementia: the Dementia Severity Scale". Alzheimer Dis Assoc Disord 19 (4): 186–94. PMID 16327345.
- ↑ Antoine C, Antoine P, Guermonprez P, Frigard B (2004). "[Awareness of deficits and anosognosia in Alzheimer's disease.]" (in French) 30 (6): 570–7. PMID 15738860.
- ↑ Cruz VT, Pais J, Teixeira A, Nunes B (2004). "[The initial symptoms of Alzheimer disease: caregiver perception]" (in Portuguese). Acta Med Port 17 (6): 435–44. PMID 16197855.
- ↑ Clarfield AM (October 2003). "The decreasing prevalence of reversible dementias: an updated meta-analysis". Arch. Intern. Med. 163 (18): 2219–29. DOI:10.1001/archinte.163.18.2219. PMID 14557220.
- ↑ Geldmacher DS, Whitehouse PJ (May 1997). "Differential diagnosis of Alzheimer's disease". Neurology 48 (5 Suppl 6): S2–9. PMID 9153154.
- ↑ Potter GG, Steffens DC (May 2007). "Contribution of depression to cognitive impairment and dementia in older adults". Neurologist 13 (3): 105–17. DOI:10.1097/01.nrl.0000252947.15389.a9. PMID 17495754.
- ↑ Bonte FJ, Harris TS, Hynan LS, Bigio EH, White CL (July 2006). "Tc-99m HMPAO SPECT in the differential diagnosis of the dementias with histopathologic соnfirmation". Clin Nucl Med 31 (7): 376–8. DOI:10.1097/01.rlu.0000222736.81365.63. PMID 16785801.
- ↑ Dougall NJ, Bruggink S, Ebmeier KP (2004). "Systematic review of the diagnostic accuracy of 99mTc-HMPAO-SPECT in dementia". Am J Geriatr Psychiatry 12 (6): 554–70. DOI:10.1176/appi.ajgp.12.6.554. PMID 15545324.
- ↑ PiB PET:
- Kemppainen NM, Aalto S, Karrasch M, et al (January 2008). "Cognitive reserve hypothesis: Pittsburgh Compound B and fluorodeoxyglucose positron emission tomography in relation to education in mild Alzheimer's disease". Ann. Neurol. 63 (1): 112–8. DOI:10.1002/ana.21212. PMID 18023012.
- Ikonomovic MD, Klunk WE, Abrahamson EE, et al (June 2008). "Post-mortem correlates of in vivo PiB-PET amyloid imaging in a typical case of Alzheimer's disease". Brain 131 (Pt 6): 1630–45. DOI:10.1093/brain/awn016. PMID 18339640.
- Jack CR, Lowe VJ, Senjem ML, et al (March 2008). "11C PiB and structural MRI provide complementary information in imaging of Alzheimer's disease and amnestic mild cognitive impairment". Brain 131 (Pt 3): 665–80. DOI:10.1093/brain/awm336. PMID 18263627.
- ↑ Marksteiner J, Hinterhuber H, Humpel C (June 2007). "Cerebrospinal fluid biomarkers for diagnosis of Alzheimer's disease: beta-amyloid(1-42), tau, phospho-tau-181 and total protein". Drugs Today 43 (6): 423–31. DOI:10.1358/dot.2007.43.6.1067341. PMID 17612711.
- ↑ Prevention recommendations not supported:
- Kawas CH (2006). "Medications and diet: protective factors for AD?". Alzheimer Dis Assoc Disord 20 (3 Suppl 2): S89–96. PMID 16917203.
- Luchsinger JA, Mayeux R (2004). "Dietary factors and Alzheimer's disease". Lancet Neurol 3 (10): 579–87. DOI:10.1016/S1474-4422(04)00878-6. PMID 15380154.
- Luchsinger JA, Noble JM, Scarmeas N (2007). "Diet and Alzheimer's disease". Curr Neurol Neurosci Rep 7 (5): 366–72. DOI:10.1007/s11910-007-0057-8. PMID 17764625.
- ↑ Szekely CA, Breitner JC, Zandi PP (2007). "Prevention of Alzheimer's disease". Int Rev Psychiatry 19 (6): 693–706. DOI:10.1080/09540260701797944. PMID 18092245.
- ↑ Mediterranean diet:
- Scarmeas N, Stern Y, Mayeux R, Luchsinger JA (2006). "Mediterranean diet, Alzheimer disease, and vascular mediation". Arch. Neurol. 63 (12): 1709–1717. DOI:10.1001/archneur.63.12.noc60109. PMID 17030648.
- Scarmeas N, Luchsinger JA, Mayeux R, Stern Y (2007). "Mediterranean diet and Alzheimer disease mortality". Neurology 69 (11): 1084–93. DOI:10.1212/01.wnl.0000277320.50685.7c. PMID 17846408.
- Barberger-Gateau P, Raffaitin C, Letenneur L, Berr C, Tzourio C, Dartigues JF, Alpérovitch A (2007). "Dietary patterns and risk of dementia: the Three-City cohort study". Neurology 69 (20): 1921–1930. DOI:10.1212/01.wnl.0000278116.37320.52. PMID 17998483.
- Dai Q, Borenstein AR, Wu Y, Jackson JC, Larson EB (2006). "Fruit and vegetable juices and Alzheimer's disease: the Kame Project". American Journal of Medicine 119 (9): 751–759. DOI:10.1016/j.amjmed.2006.03.045. PMID 16945610.
- Savaskan E, Olivieri G, Meier F, Seifritz E, Wirz-Justice A, Müller-Spahn F (2003). "Red wine ingredient resveratrol protects from beta-amyloid neurotoxicity". Gerontology 49 (6): 380–383. DOI:10.1159/000073766. PMID 14624067.
- ↑ Vitamins prevent:
- Morris MC, Schneider JA, Tangney CC (2006). "Thoughts on B-vitamins and dementia". J. Alzheimers Dis. 9 (4): 429–33. PMID 16917152.
- Landmark K (2006). "[Could intake of vitamins C and E inhibit development of Alzheimer dementia?]" (in Norwegian). Tidsskr. Nor. Laegeforen. 126 (2): 159–61. PMID 16415937.
- Luchsinger JA, Tang MX, Miller J, Green R, Mayeux R (2007). "Relation of higher folate intake to lower risk of Alzheimer disease in the elderly". Arch. Neurol. 64 (1): 86–92. DOI:10.1001/archneur.64.1.86. PMID 17210813.
- Morris MC, Evans DA, Bienias JL, et al (August 2004). "Dietary niacin and the risk of incident Alzheimer's disease and of cognitive decline". J. Neurol. Neurosurg. Psychiatr. 75 (8): 1093–9. DOI:10.1136/jnnp.2003.025858. PMID 15258207.
- ↑ Vitamins do not prevent:
- Morris MC, Evans DA, Schneider JA, Tangney CC, Bienias JL, Aggarwal NT (2006). "Dietary folate and vitamins B-12 and B-6 not associated with incident Alzheimer's disease". J. Alzheimers Dis. 9 (4): 435–43. PMID 16917153.
- Malouf M, Grimley EJ, Areosa SA (2003). "Folic acid with or without vitamin B12 for cognition and dementia". Cochrane Database Syst Rev (4): CD004514. DOI:10.1002/14651858.CD004514. PMID 14584018.
- Sun Y, Lu CJ, Chien KL, Chen ST, Chen RC (2007). "Efficacy of multivitamin supplementation containing vitamins B6 and B12 and folic acid as adjunctive treatment with a cholinesterase inhibitor in Alzheimer's disease: a 26-week, randomised, double-blind, placebo-controlled study in Taiwanese patients". Clin Ther 29 (10): 2204–14. DOI:10.1016/j.clinthera.2007.10.012. PMID 18042476.
- Boothby LA, Doering PL (2005). "Vitamin C and vitamin E for Alzheimer's disease". Ann Pharmacother 39 (12): 2073–80. DOI:10.1345/aph.1E495. PMID 16227450.
- Gray SL, Anderson ML, Crane PK, Breitner JC, McCormick W, Bowen JD, Teri L, Larson E (2008). "Antioxidant vitamin supplement use and risk of dementia or Alzheimer's disease in older adults". J Am Geriatr Soc 56 (2): 291–295. DOI:10.1111/j.1532-5415.2007.01531.x. PMID 18047492.
- ↑ Curcumin in diet:
- Garcia-Alloza M, Borrelli LA, Rozkalne A, Hyman BT, Bacskai BJ (2007). "Curcumin labels amyloid pathology in vivo, disrupts existing plaques, and partially restores distorted neurites in an Alzheimer mouse model". Journal of Neurochemistry 102 (4): 1095–1104. DOI:10.1111/j.1471-4159.2007.04613.x. PMID 17472706.
- Lim GP, Chu T, Yang F, Beech W, Frautschy SA, Cole GM (2001). "The curry spice curcumin reduces oxidative damage and amyloid pathology in an Alzheimer transgenic mouse". Journal of Neuroscience 21 (21): 8370–8377. PMID 11606625.
- ↑ Rosendorff C, Beeri MS, Silverman JM (2007). "Cardiovascular risk factors for Alzheimer's disease". Am J Geriatr Cardiol 16 (3): 143–9. PMID 17483665.
- ↑ Patterson C, Feightner JW, Garcia A, Hsiung GY, MacKnight C, Sadovnick AD (February 2008). "Diagnosis and treatment of dementia: 1. Risk assessment and primary prevention of Alzheimer disease". CMAJ 178 (5): 548–56. DOI:10.1503/cmaj.070796. PMID 18299540.
- ↑ Reiss AB, Wirkowski E (2007). "Role of HMG-CoA reductase inhibitors in neurological disorders : progress to date". Drugs 67 (15): 2111–20. PMID 17927279.
- ↑ Kuller LH (August 2007). "Statins and dementia". Curr Atheroscler Rep 9 (2): 154–61. PMID 17877925.
- ↑ Szekely CA, Breitner JC, Fitzpatrick AL, et al (January 2008). "NSAID use and dementia risk in the Cardiovascular Health Study: role of APOE and NSAID type". Neurology 70 (1): 17–24. DOI:10.1212/01.wnl.0000284596.95156.48. PMID 18003940.
- ↑ Craig MC, Murphy DG (October 2007). "Estrogen: effects on normal brain function and neuropsychiatric disorders". Climacteric 10 Suppl 2: 97–104. DOI:10.1080/13697130701598746. PMID 17882683.
- ↑ Mori K, Takeda M (September 2007). "[Hormone replacement Up-to-date. Hormone replacement therapy and brain function]" (in Japanese). Clin Calcium 17 (9): 1349–54. DOI:CliCa070913491354. PMID 17767023.
- ↑ Birks J, Grimley Evans J (2007). "Ginkgo biloba for cognitive impairment and dementia". Cochrane Database Syst Rev (2): CD003120. DOI:10.1002/14651858.CD003120.pub2. PMID 17443523. Проверено 2008-02-22.
- ↑ DeKosky ST, Williamson JD, Fitzpatrick AL et al. (2008). "Ginkgo biloba for Prevention of Dementia". Journal of the American Medical Association 300 (19): 2253-2262. Проверено 2008-11-18.
- ↑ Verghese J, Lipton RB, Katz MJ, et al (June 2003). "Leisure activities and the risk of dementia in the elderly". N. Engl. J. Med. 348 (25): 2508–16. DOI:10.1056/NEJMoa022252. PMID 12815136.
- ↑ Bennett DA, Schneider JA, Tang Y, Arnold SE, Wilson RS (2006). "The effect of social networks on the relation between Alzheimer's disease pathology and level of cognitive function in old people: a longitudinal cohort study". Lancet Neurol 5 (5): 406–412. DOI:10.1016/S1474-4422(06)70417-3. PMID 16632311.
- ↑ Bialystok E, Craik FIM, Freedman M (2007). "Bilingualism as a protection against the onset of symptoms of dementia". Neuropsychologia 42 (2): 459–464. DOI:10.1016/j.neuropsychologia.2006.10.009.
- ↑ Davanipour Z, Tseng CC, Lee PJ, Sobel E (2007). "A case-control study of occupational magnetic field exposure and Alzheimer's disease: results from the California Alzheimer's Disease Diagnosis and Treatment Centers". BMC Neurol 7: 13. DOI:10.1186/1471-2377-7-13. PMID 17559686.
- ↑ Qiu C, Fratiglioni L, Karp A, Winblad B, Bellander T (November 2004). "Occupational exposure to electromagnetic fields and risk of Alzheimer's disease". Epidemiology 15 (6): 687–94. PMID 15475717. Проверено 2008-09-22.
- ↑ Shcherbatykh I, Carpenter DO (May 2007). "The role of metals in the etiology of Alzheimer's disease". J. Alzheimers Dis. 11 (2): 191–205. PMID 17522444.
- ↑ Rondeau V, Commenges D, Jacqmin-Gadda H, Dartigues JF (July 2000). "Relation between aluminum concentrations in drinking water and Alzheimer's disease: an 8-year follow-up study". Am. J. Epidemiol. 152 (1): 59–66. PMID 10901330.
- ↑ Kukull WA, Larson EB, Bowen JD, et al (June 1995). "Solvent exposure as a risk factor for Alzheimer's disease: a case-control study". Am. J. Epidemiol. 141 (11): 1059–71; discussion 1072–9. PMID 7771442.
- ↑ Santibáñez M, Bolumar F, García AM (2007). "Occupational risk factors in Alzheimer's disease: a review assessing the quality of published epidemiological studies". Occupational and Environmental Medicine 64 (11): 723–732. DOI:10.1136/oem.2006.028209. PMID 17525096.
- ↑ Seidler A, Geller P, Nienhaus A, et al (February 2007). "Occupational exposure to low frequency magnetic fields and dementia: a case-control study". Occup Environ Med 64 (2): 108–14. DOI:10.1136/oem.2005.024190. PMID 17043077.
- ↑ Rondeau V (2002). "A review of epidemiologic studies on aluminum and silica in relation to Alzheimer's disease and associated disorders". Rev Environ Health 17 (2): 107–21. PMID 12222737.
- ↑ Martyn CN, Coggon DN, Inskip H, Lacey RF, Young WF (May 1997). "Aluminum concentrations in drinking water and risk of Alzheimer's disease". Epidemiology 8 (3): 281–6. PMID 9115023.
- ↑ Graves AB, Rosner D, Echeverria D, Mortimer JA, Larson EB (September 1998). "Occupational exposures to solvents and aluminium and estimated risk of Alzheimer's disease". Occup Environ Med 55 (9): 627–33. PMID 9861186.
- ↑ Geula C, Mesulam MM (1995). "Cholinesterases and the pathology of Alzheimer disease". Alzheimer Dis Assoc Disord 9 Suppl 2: 23–28. PMID 8534419.
- ↑ Stahl SM (2000). "The new cholinesterase inhibitors for Alzheimer's disease, Part 2: illustrating their mechanisms of action". J Clin Psychiatry 61 (11): 813–814. PMID 11105732.
- ↑ Donepezil. US National Library of Medicine (Medline Plus) (2007-01-08). Проверено 20 марта 2008.
- ↑ Galantamine. US National Library of Medicine (Medline Plus) (2007-01-08). Проверено 20 марта 2008.
- ↑ Rivastigmine. US National Library of Medicine (Medline Plus) (2007-01-08). Проверено 20 марта 2008.
- ↑ Rivastigmine Transdermal. US National Library of Medicine (Medline Plus) (2007-01-08). Проверено 20 марта 2008.
- ↑ Birks J (2006). "Cholinesterase inhibitors for Alzheimer's disease". Cochrane Database Syst Rev (1): CD005593. DOI:10.1002/14651858.CD005593. PMID 16437532.
- ↑ Birks J, Harvey RJ (2006). "Donepezil for dementia due to Alzheimer's disease". Cochrane Database Syst Rev (1): CD001190. DOI:10.1002/14651858.CD001190.pub2. PMID 16437430.
- ↑ Raschetti R, Albanese E, Vanacore N, Maggini M (2007). "Cholinesterase inhibitors in mild cognitive impairment: a systematic review of randomised trials". PLoS Med 4 (11): e338. DOI:10.1371/journal.pmed.0040338. PMID 18044984.
- ↑ Acetylcholinesterase inhibitors prescribing information:
- Aricept Prescribing information (PDF). Eisai and Pfizer. Проверено 18 августа 2008.
- Razadyne ER U.S. Full Prescribing Information (PDF). Ortho-McNeil Neurologics. Проверено 19 февраля 2008.
- Exelon ER U.S. Prescribing Information (PDF). Novartis Pharmaceuticals. Проверено 19 февраля 2008.
- Exelon U.S. Prescribing Information (PDF). Novartis Pharmaceuticals. Проверено 21 февраля 2008.
- Exelon Warning Letter (PDF). FDA.
- ↑ 1 2 Lipton SA (2006). "Paradigm shift in neuroprotection by NMDA receptor blockade: memantine and beyond". Nat Rev Drug Discov 5 (2): 160–170. DOI:10.1038/nrd1958. PMID 16424917.
- ↑ Memantine. US National Library of Medicine (Medline) (2004-01-04). Проверено 22 марта 2008.
- ↑ Areosa Sastre A, McShane R, Sherriff F (2004). "Memantine for dementia". Cochrane Database Syst Rev (4): CD003154. DOI:10.1002/14651858.CD003154.pub2. PMID 15495043.
- ↑ Namenda Prescribing Information (PDF). Forest Pharmaceuticals. Проверено 19 февраля 2008.
- ↑ Raina P, Santaguida P, Ismaila A, et al (2008). "Effectiveness of cholinesterase inhibitors and memantine for treating dementia: evidence review for a clinical practice guideline". Annals of Internal Medicine 148 (5): 379–397. PMID 18316756.
- ↑ Antipsychotics use:
- Ballard C, Waite J (2006). "The effectiveness of atypical antipsychotics for the treatment of aggression and psychosis in Alzheimer's disease". Cochrane Database Syst Rev (1): CD003476. DOI:10.1002/14651858.CD003476.pub2. PMID 16437455.
- Ballard C, Lana MM, Theodoulou M, et al (2008). "A Randomised, Blinded, Placebo-Controlled Trial in Dementia Patients Continuing or Stopping Neuroleptics (The DART-AD Trial)". PLoS Med. 5 (4): e76. DOI:10.1371/journal.pmed.0050076. PMID 18384230.
- Sink KM, Holden KF, Yaffe K (2005). "Pharmacological treatment of neuropsychiatric symptoms of dementia: a review of the evidence". JAMA 293 (5): 596–608. DOI:10.1001/jama.293.5.596. PMID 15687315.
- ↑ 1 2 Ballard C, Hanney ML, Theodoulou M, Douglas S, McShane R, Kossakowski K, Gill R, Juszczak E, Yu L-M, Jacoby R (9 January 2009). "The dementia antipsychotic withdrawal trial (DART-AD): long-term follow-up of a randomised placebo-controlled trial". Lancet Neurology. DOI:10.1016/S1474-4422(08)70295-3. PMID 19138567. Lay summary.
- ↑ 1 2 3 4 5 6 7 Practice Guideline for the Treatment of Patients with Alzheimer's disease and Other Dementias (PDF). American Psychiatric Association (October 2007). doi:10.1176/appi.books.9780890423967.152139. Проверено 28 декабря 2007.
- ↑ Bottino CM, Carvalho IA, Alvarez AM, et al (2005). "Cognitive rehabilitation combined with drug treatment in Alzheimer's disease patients: a pilot study". Clin Rehabil 19 (8): 861–869. DOI:10.1191/0269215505cr911oa. PMID 16323385.
- ↑ Doody RS, Stevens JC, Beck C, et al (2001). "Practice parameter: management of dementia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology". Neurology 56 (9): 1154–1166. PMID 11342679.
- ↑ Hermans DG, Htay UH, McShane R (2007). "Non-pharmacological interventions for wandering of people with dementia in the domestic setting". Cochrane Database Syst Rev (1): CD005994. DOI:10.1002/14651858.CD005994.pub2. PMID 17253573.
- ↑ Robinson L, Hutchings D, Dickinson HO, et al (2007). "Effectiveness and acceptability of non-pharmacological interventions to reduce wandering in dementia: a systematic review". Int J Geriatr Psychiatry 22 (1): 9–22. DOI:10.1002/gps.1643. PMID 17096455.
- ↑ Woods B, Spector A, Jones C, Orrell M, Davies S (2005). "Reminiscence therapy for dementia". Cochrane Database Syst Rev (2): CD001120. DOI:10.1002/14651858.CD001120.pub2. PMID 15846613.
- ↑ Peak JS, Cheston RI (2002). "Using simulated presence therapy with people with dementia". Aging Ment Health 6 (1): 77–81. DOI:10.1080/13607860120101095. PMID 11827626.
- ↑ Camberg L, Woods P, Ooi WL, et al (1999). "Evaluation of Simulated Presence: a personalised approach to enhance well-being in persons with Alzheimer's disease". J Am Geriatr Soc 47 (4): 446–452. PMID 10203120.
- ↑ Neal M, Briggs M (2003). "Validation therapy for dementia". Cochrane Database Syst Rev (3): CD001394. DOI:10.1002/14651858.CD001394. PMID 12917907.
- ↑ Chung JC, Lai CK, Chung PM, French HP (2002). "Snoezelen for dementia". Cochrane Database Syst Rev (4): CD003152. DOI:10.1002/14651858.CD003152. PMID 12519587.
- ↑ Spector A, Orrell M, Davies S, Woods B (2000). "Withdrawn: Reality orientation for dementia". Cochrane Database Syst Rev (3): CD001119. DOI:10.1002/14651858.CD001119.pub2. PMID 17636652.
- ↑ Spector A, Thorgrimsen L, Woods B, et al (2003). "Efficacy of an evidence-based cognitive stimulation therapy programme for people with dementia: randomised controlled trial". Br J Psychiatry 183: 248–254. DOI:10.1192/bjp.183.3.248. PMID 12948999.
- ↑ Gitlin LN, Corcoran M, Winter L, Boyce A, Hauck WW (February 2001). "A randomized, controlled trial of a home environmental intervention: effect on efficacy and upset in caregivers and on daily function of persons with dementia". Gerontologist 41 (1): 4–14. PMID 11220813. Проверено 2008-07-15.
- ↑ Gitlin LN, Hauck WW, Dennis MP, Winter L (March 2005). "Maintenance of effects of the home environmental skill-building program for family caregivers and individuals with Alzheimer's disease and related disorders". J. Gerontol. A Biol. Sci. Med. Sci. 60 (3): 368–74. PMID 15860476.
- ↑ Treating behavioral and psychiatric symptoms. Alzheimer's Association (2006). Проверено 25 сентября 2006.
- ↑ Dunne TE, Neargarder SA, Cipolloni PB, Cronin-Golomb A (2004). "Visual contrast enhances food and liquid intake in advanced Alzheimer's disease". Clinical Nutrition 23 (4): 533–538. DOI:10.1016/j.clnu.2003.09.015. PMID 15297089.
- ↑ Nutrition essentials for nursing practice. — Hagerstown, Maryland: Lippincott Williams & Wilkins, 2007. — С. 360. — ISBN 0-7817-6651-6
- ↑ Dennehy C (2006). "Analysis of patients' rights: dementia and PEG insertion". Br J Nurs 15 (1): 18–20. PMID 16415742.
- ↑ Chernoff R (April 2006). "Tube feeding patients with dementia". Nutr Clin Pract 21 (2): 142–6. PMID 16556924.
- ↑ Medical issues:
- Head B (January 2003). "Palliative care for persons with dementia". Home Healthc Nurse 21 (1): 53–60; quiz 61. PMID 12544465.
- Friedlander AH, Norman DC, Mahler ME, Norman KM, Yagiela JA (September 2006). "Alzheimer's disease: psychopathology, medical management and dental implications". J Am Dent Assoc 137 (9): 1240–51. PMID 16946428.
- Belmin J (2007). "Practical guidelines for the diagnosis and management of weight loss in Alzheimer's disease: a consensus from appropriateness ratings of a large expert panel". J Nutr Health Aging 11 (1): 33–7. PMID 17315078.
- McCurry SM, Gibbons LE, Logsdon RG, Vitiello M, Teri L (October 2003). "Training caregivers to change the sleep hygiene practices of patients with dementia: the NITE-AD project". J Am Geriatr Soc 51 (10): 1455–60. PMID 14511168.
- Perls TT, Herget M (December 1995). "Higher respiratory infection rates on an Alzheimer's special care unit and successful intervention". J Am Geriatr Soc 43 (12): 1341–4. PMID 7490383.
- ↑ Shega JW, Levin A, Hougham GW, et al (April 2003). "Palliative Excellence in Alzheimer Care Efforts (PEACE): a program description". J Palliat Med 6 (2): 315–20. DOI:10.1089/109662103764978641. PMID 12854952.
- ↑ 1 2 Bowen JD, Malter AD, Sheppard L, et al (August 1996). "Predictors of mortality in patients diagnosed with probable Alzheimer's disease". Neurology 47 (2): 433–9. PMID 8757016.
- ↑ 1 2 Dodge HH, Shen C, Pandav R, DeKosky ST, Ganguli M (February 2003). "Functional transitions and active life expectancy associated with Alzheimer disease". Arch. Neurol. 60 (2): 253–9. PMID 12580712.
- ↑ Larson EB, Shadlen MF, Wang L, et al (April 2004). "Survival after initial diagnosis of Alzheimer disease". Ann. Intern. Med. 140 (7): 501–9. PMID 15068977.
- ↑ Jagger C, Clarke M, Stone A (January 1995). "Predictors of survival with Alzheimer's disease: a community-based study". Psychol Med 25 (1): 171–7. PMID 7792352.
- ↑ 1 2 Ganguli M, Dodge HH, Shen C, Pandav RS, DeKosky ST (May 2005). "Alzheimer disease and mortality: a 15-year epidemiological study". Arch. Neurol. 62 (5): 779–84. DOI:10.1001/archneur.62.5.779. PMID 15883266.
- ↑ Allegri RF, Butman J, Arizaga RL, et al (August 2007). "Economic impact of dementia in developing countries: an evaluation of costs of Alzheimer-type dementia in Argentina". Int Psychogeriatr 19 (4): 705–18. DOI:10.1017/S1041610206003784. PMID 16870037.
- ↑ Suh GH, Knapp M, Kang CJ (August 2006). "The economic costs of dementia in Korea, 2002". Int J Geriatr Psychiatry 21 (8): 722–8. DOI:10.1002/gps.1552. PMID 16858741.
- ↑ Wimo A, Jonsson L, Winblad B (2006). "An estimate of the worldwide prevalence and direct costs of dementia in 2003". Dement Geriatr Cogn Disord 21 (3): 175–81. DOI:10.1159/000090733. PMID 16401889.
- ↑ 1 2 3 Moore MJ, Zhu CW, Clipp EC (July 2001). "Informal costs of dementia care: estimates from the National Longitudinal Caregiver Study". J Gerontol B Psychol Sci Soc Sci 56 (4): S219–28. PMID 11445614.
- ↑ Jönsson L, Eriksdotter Jönhagen M, Kilander L, et al (May 2006). "Determinants of costs of care for patients with Alzheimer's disease". Int J Geriatr Psychiatry 21 (5): 449–59. DOI:10.1002/gps.1489. PMID 16676288.
- ↑ 1 2 Zhu CW, Sano M (2006). "Economic considerations in the management of Alzheimer's disease". Clin Interv Aging 1 (2): 143–54. PMID 18044111.
- ↑ Gaugler JE, Kane RL, Kane RA, Newcomer R (April 2005). "Early community-based service utilization and its effects on institutionalization in dementia caregiving". Gerontologist 45 (2): 177–85. PMID 15799982.
- ↑ Ritchie K, Lovestone S (November 2002). "The dementias". Lancet 360 (9347): 1759–66. DOI:10.1016/S0140-6736(02)11667-9. PMID 12480441.
- ↑ Brodaty H, Hadzi-Pavlovic D (September 1990). "Psychosocial effects on carers of living with persons with dementia". Aust N Z J Psychiatry 24 (3): 351–61. PMID 2241719.
- ↑ Donaldson C, Tarrier N, Burns A (April 1998). "Determinants of carer stress in Alzheimer's disease". Int J Geriatr Psychiatry 13 (4): 248–56. PMID 9646153.
- ↑ The MetLife Study of Alzheimer’s Disease: The Caregiving Experience (PDF). MetLife Mature Market Institute (August 2006). Проверено 12 февраля 2008.
- ↑ Pusey H, Richards D (May 2001). "A systematic review of the effectiveness of psychosocial interventions for carers of people with dementia". Aging Ment Health 5 (2): 107–19. PMID 11511058.
- ↑ Garrard P, Maloney LM, Hodges JR, Patterson K (February 2005). "The effects of very early Alzheimer's disease on the characteristics of writing by a renowned author". Brain 128 (Pt 2): 250–60. DOI:10.1093/brain/awh341. PMID 15574466.
- ↑ Sherman FT (September 2004). "Did President Reagan have mild cognitive impairment while in office? Living longer with Alzheimer's Disease". Geriatrics 59 (9): 11, 15. PMID 15461232.
- ↑ Hungary legend Puskas dies at 79. BBC News (2006-11-17). Проверено 25 января 2008.
- ↑ Prime Ministers in History: Harold Wilson. London: 10 Downing Street. Проверено 18 августа 2008.
- ↑ "Mi padre no reconoció al Rey pero notó el cariño". Madrid: El País (2008). Проверено 1 октября 2008.
- ↑ Chicago Rita Hayworth Gala. Alzheimer’s Association (2007). Проверено 25 января 2008.
- ↑ Charlton Heston has Alzheimer's symptoms. CNN (2002-08-09). Проверено 25 января 2008.
- ↑ Pauli Michelle. Pratchett announces he has Alzheimer's, Guardian News and Media (2007-12-12). Проверено 2008-08-18.
- ↑ Iris. IMDB (2002-01-18). Проверено 24 января 2008.
- ↑ Iris: a memoir of Iris Murdoch. — London: Abacus, 2000. — ISBN 9780349112152
- ↑ The notebook. IMDB. Проверено 22 февраля 2008.
- ↑ The notebook. — Thorndike, Maine: Thorndike Press, 1996. — С. 268. — ISBN 078620821X
- ↑ Thanmathra. Webindia123.com. Проверено 24 января 2008.
- ↑ Ashita no kioku. IMDB. Проверено 24 января 2008.
- ↑ Ashita no Kioku. — Tōkyō: Kōbunsha, 2004. — ISBN 9784334924461
- ↑ Hateship, Friendship, Courtship, Loveship, Marriage. — New York: A.A. Knopf, 2001. — ISBN 9780375413001
- ↑ Malcolm and Barbara:
- Malcolm and Barbara: A love story. Dfgdocs. Проверено 24 января 2008.
- Malcolm and Barbara: A love story. BBC Cambridgeshire. Проверено 2 марта 2008.
- Alzheimer's film-maker to face ITV lawyers, Guardian Media (2007-08-07). Проверено 2008-01-24.
- ↑ Clinical Trials. Found 459 studies with search of: alzheimer. US National Institutes of Health. Проверено 23 марта 2008.
- ↑ Vaccination:
- Hawkes CA, McLaurin J (November 2007). "Immunotherapy as treatment for Alzheimer's disease". Expert Rev Neurother 7 (11): 1535–48. DOI:10.1586/14737175.7.11.1535. PMID 17997702.
- Solomon B (June 2007). "Clinical immunologic approaches for the treatment of Alzheimer's disease". Expert Opin Investig Drugs 16 (6): 819–28. DOI:10.1517/13543784.16.6.819. PMID 17501694.
- Woodhouse A, Dickson TC, Vickers JC (2007). "Vaccination strategies for Alzheimer's disease: A new hope?". Drugs Aging 24 (2): 107–19. PMID 17313199.
- ↑ Study Evaluating ACC-001 in Mild to Moderate Alzheimers Disease Subjects. Clinical Trial. US National Institutes of Health (2008-03-11). Проверено 5 июня 2008.
- ↑ Study Evaluating Safety, Tolerability, and Immunogenicity of ACC-001 in Subjects With Alzheimer's Disease. US National Institutes of Health. Проверено 5 июня 2008.
- ↑ Alzheimer's Disease Vaccine Trial Suspended on Safety Concern. Medpage Today (2008-04-18). Проверено 14 июня 2008.
- ↑ Bapineuzumab in Patients With Mild to Moderate Alzheimer's Disease/ Apo_e4 non-carriers. Clinical Trial. US National Institutes of Health (2008-02-29). Проверено 23 марта 2008.
- ↑ Safety, Tolerability and Efficacy Study to Evaluate Subjects With Mild Cognitive Impairment. Clinical Trial. US National Institutes of Health (2008-03-11). Проверено 23 марта 2008.
- ↑ Study Evaluating the Safety, Tolerability and Efficacy of PBT2 in Patients With Early Alzheimer's Disease. Clinical Trial. US National Institutes of Health (2008-01-13). Проверено 23 марта 2008.
- ↑ Etanercept research:
- Tobinick E, Gross H, Weinberger A, Cohen H (2006). "TNF-alpha modulation for treatment of Alzheimer's disease: a 6-month pilot study". MedGenMed 8 (2): 25. PMID 16926764.
- Griffin WS (2008). "Perispinal etanercept: potential as an Alzheimer therapeutic". J Neuroinflammation 5: 3. DOI:10.1186/1742-2094-5-3. PMID 18186919.
- Tobinick E (December 2007). "Perispinal etanercept for treatment of Alzheimer's disease". Curr Alzheimer Res 4 (5): 550–2. PMID 18220520.
- ↑ Wischik Claude M, Bentham Peter, Wischik Damon J, Seng Kwang Meng (July 2008). "Tau aggregation inhibitor (TAI) therapy with remberTM arrests disease progression in mild and moderate Alzheimer's disease over 50 weeks". Alzheimer's & Dementia 4 (4). DOI:10.1016/j.jalz.2008.05.438. Проверено 2008-07-30.
- ↑ Harrington Charles, Rickard Janet E, Horsley David, et al (July 2008). "Methylthioninium chloride (MTC) acts as a Tau aggregation inhibitor (TAI) in a cellular model and reverses Tau pathology in transgenic mouse models of Alzheimer's disease". Alzheimer's & Dementia 4: T120–T121. DOI:10.1016/j.jalz.2008.05.259.
- ↑ Doody RS, Gavrilova SI, Sano M, et al (July 2008). "Effect of dimebon on cognition, activities of daily living, behaviour, and global function in patients with mild-to-moderate Alzheimer's disease: a randomised, double-blind, placebo-controlled study". Lancet 372 (9634): 207–15. DOI:10.1016/S0140-6736(08)61074-0. PMID 18640457.
Чтение по теме
На русском языке:
- Ю. Г. Каминский, Е. А. Косенко "Популярно и не очень о болезни Альцгеймера" Либроком, 2009 г., 136 стр. ISBN 978-5-397-00194-6
- Билл Грант "Старческое слабоумие. Болезнь Альцгеймера и другие формы." Alzheimer's Disease. A Carer's Guide Серия: Советы врача Норинт, 2003 г., 80 стр. ISBN 5-7711-0161-3
На английском языке:
- Cummings JL, Frank JC, Cherry D, Kohatsu ND, Kemp B, Hewett L, Mittman B (2002). "Guidelines for managing Alzheimer's disease: Part I. Assessment". American Family Physician 65 (11): 2263–2272. PMID 12074525.
- Cummings JL, Frank JC, Cherry D, Kohatsu ND, Kemp B, Hewett L, Mittman B (2002). "Guidelines for managing Alzheimer's disease: Part II. Treatment". American Family Physician 65 (12): 2525–2534. PMID 12086242.
- Genes, lifestyles, and crossword puzzles: Can Alzheimer's disease be prevented? (PDF). US Department of Health and Human Services, National Institute on Aging. Проверено 29 февраля 2008.
- Russell D, Barston S, White M Alzheimer’s Behavior Management: Learn to manage common behavior problems. helpguide.org (2007-12-19). Проверено 29 февраля 2008.
- Alzheimer's Disease: Unraveling the Mystery. — National Institute on Aging, 2003.
Ссылки
- проф. Перфильева Г.М. “Болезнь Альцгеймера (проблемы ухода за больным)”
- “Современные представления о болезни Альцгеймера”
Заболевания ЦНС Головной мозг
ЭнцефалопатияВоспалительные заболевания Менингит • Арахноидит • Энцефалит • Менингоэнцефалит • Тромбоз кавернозного синуса Системная атрофия Болезнь Хантингтона • Спинномозговая атаксия
Спинальная мышечная атрофия: Синдром Кеннеди • Спинальная мышечная атрофия у детей • Болезнь двигательного нейрона • Синдром Фацио-ЛондеЭкстрапирамидная система и двигательные расстройства Заболевания базальных ганглиев: Болезнь Паркинсона • Нейролептический синдром • Пантотенаткиназа-ассоциированная нейродегенерация • Прогрессирующий надъядерный паралич • Стриатонигральная дегенерация • Гемибаллизм
Дискинезия: Дистония • Хорея • Миоклония • Эссенциальный тремор • Синдром беспокойных ног • Синдром мышечной скованностиДеменция Болезнь Альцгеймера • Лобно-височная деменция/Лобно-височная лобарная дегенерация • Мультиинфарктная деменция Митохондриальные заболевания Синдром Лейка Демиелинизирующие заболевания Аутоиммунные заболевания (Рассеянный склероз, Оптикомиелит) • Наследственные заболевания (Адренолейкодистрофия) • Центральный понтинный миелинолиз • Синдром Маркиафавы — Биньями • Синдром Альперса Эпилептические припадки
ЭпилепсияЛокализованная эпилепсия • Генерализованная эпилепсия • Эпилептический статус • Миоклоническая эпилепсия Головная боль Мигрень • Кластерная головная боль • Сосудистая головная боль • Головная боль напряжения Сосудистые Транзиторная ишемическая атака • Цереброваскулярная болезнь (Дисциркуляторная энцефалопатия) • Инсульт (Ишемический инсульт, Внутримозговое кровоизлияние, Субарахноидальное кровоизлияние) Расстройства сна Бессонница • Гиперсомния • Апноэ сна • Нарколепсия • Катаплексия • Синдром Клейна-Левина • Нарушения цикличности сна и бодрствования Спинномозговая жидкость Внутричерепная гипертензия • Отёк мозга • Внутричерепная гипотензия Другие заболевания Спинномозговая грыжа • Синдром Рея • Печеночная кома • Токсическая энцефалопатия Спинной мозг
МиелопатияВоспалительные заболевания Менингит • Арахноидит • Менингоэнцефалит • Миелит • Полиомиелит • Демиелинизирующие заболевания • Тропический спастический парапарез Другие заболевания Сирингомиелия • Сирингобульбия • Синдром Морвана • Сосудитая миелопатия • Сдавление спинного мозга • Энцефаломиелит
Wikimedia Foundation. 2010.