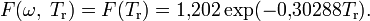- Уравнение состояния Редлиха — Квонга
-
Уравнение состояния Редлиха — Квонга
Уравнение состояния 
Статья является частью серии «Термодинамика». Уравнение состояния идеального газа Уравнение Ван-дер-Ваальса Уравнение Дитеричи Уравнение состояния Редлиха — Квонга Уравнение состояния Барнера — Адлера Уравнение состояния Суги — Лю Уравнение состояния Бенедикта — Вебба — Рубина Уравнение состояния Ли — Эрбара — Эдмистера Разделы термодинамики Начала термодинамики Уравнение состояния Термодинамические величины Термодинамические потенциалы Термодинамические циклы Фазовые переходы править Уравнение состояния Редлиха — Квонга — двухпараметрическое уравнение состояния реального газа, полученное О. Редлихом (англ. O. Redlich) и Дж. Квонгом (англ. J. N. S. Kwong) в 1949 году как улучшение уравнения Ван-дер-Ваальса[1]. При этом Отто Редлих в своей статье[2] 1975 года пишет, что уравнение не опирается на теоретические обоснования, а является по сути удачной эмпирической модификацией ранее известных уравнений.
Уравнение имеет вид:
где P — давление, Па;
- T — абсолютная температура, К;
- V — мольный объём, м³/моль;
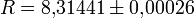 — универсальная газовая постоянная, Дж/(моль·К);
— универсальная газовая постоянная, Дж/(моль·К);- a и b — некоторые константы, зависящие от конкретного вещества.
Из условий термодинамической устойчивости в критической точки —
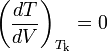 и
и 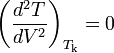 (Tk — критическая температура) — можно получить, что:
(Tk — критическая температура) — можно получить, что:где Pk — критическое давление.
Представляет интерес разрешение уравнения Редлиха — Квонга относительно коэффициента сжимаемости
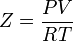 . В этом случае имеем кубическое уравнение:
. В этом случае имеем кубическое уравнение:- Z3 − Z2 + (A − B2 + B)Z − AB = 0,
где
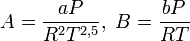 .
.Уравнение Редлиха — Квонга применимо, если выполняется условие
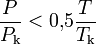 .
.После 1949 года было получено несколько обобщений и модификаций уравнения Редлиха — Квонга (см. ниже), однако как показали А. Бьерре (A. Bjerre) и Т. Бак (T. A. Bak)[3] оригинальное уравнение более точно описывает поведение газов.
Содержание
Модификация Грея — Рента — Зудкевича
Р. Грей (R. D. Gray, Jr.), Н. Рент (N. H. Rent) и Д. Зудкевич предложили[4] скорректировать коэффициент сжимаемости ZRK, полученный из кубического уравнения Редлиха — Квонга, введя корректирующий член ΔZ:
- Z' = ZRK + ΔZ,
где Z' — модифицированный коэффициент сжимаемости;
где
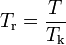 — приведённая температура,
— приведённая температура, 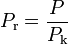 — приведённое давление, ω — фактор ацентричности (англ.) Питцера.
— приведённое давление, ω — фактор ацентричности (англ.) Питцера.Модификация Грея и др. получена для Tr < 1,1 и
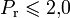 .
.Другие модификации
Дригим путём получения модификаций оригинального уравнения состояния Редлиха — Квонга является запись его в виде:
где
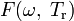 — модифицирующая функция.
— модифицирующая функция.Для самого уравнения Редлиха — Квонга
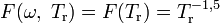 .
.Модификация Вильсона
У Г. Вильсона[5][6] (G. M. Wilson) модифицирующая функция имеет вид:
Вильсон показал, что его форма уравнения даёт хорошие результаты по поправкам к энтальпии на давление не только для полярных (включая аммиак), но и для неполярных веществ.
Модификация Барне — Кинга
Барне[7] (F. J. Barnès), а позднее Кинг[8] (C. J. King) предложили в 1973—74 годах следующую модификацию:
Барне и Кинг применяли свою модификацию также для смесей как углеводородов, так и неуглеводородов.
Модификация Соаве
Г. Соаве (G. Soave) было предложено[9] следующее уравнение:
Для водорода было получено более простое уравнение:
Вест (E. W. West) и Эрбар (J. H. Erbar), используя уравнение Соаве для систем лёгких углеводородов, пришли к выводу[10], что оно является очень точным при определении параметров фазового равновесия пар—жидкость и поправок к энтальпии на давление.
Литература
- Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей: Справочное пособие / Пер. с англ. под ред. Б. И. Соколова. — 3-е изд. — Л.: Химия, 1982. — 592 с.
- Уэйлес С. Фазовые равновесия в химической технологии: В 2-х ч. Ч. 1. — М.: Мир, 1989. — 304 с. — ISBN 5-03-001106-4.
См. также
- Уравнение состояния идеального газа
- Уравнение Ван-дер-Ваальса
- Уравнение Дитеричи
- Уравнение состояния Барнера — Адлера
- Уравнение состояния Суги — Лю
- Уравнение состояния Бенедикта — Вебба — Рубина
- Уравнение состояния Ли — Эрбара — Эдмистера
Примечания
- ↑ Redlich O., Kwong J. N. S. On the Thermodynamics of Solutions. V. An Equation of State. Fugacities of Gaseous Solutions // Chemical Reviews. — 1949. — Т. 44. — № 1. — С. 233–244.
- ↑ Redlich O. On the Three-Parameter Representation of the Equation of State // Industrial and Engineering Chemistry Fundamentals. — 1975. — В. 3. — Т. 14. — С. 257—260.
- ↑ Bjerre A., Bak T. A. Two-Parameter Equations of State // Acta Chemica Scandinavica. — 1969. — Т. 23. — С. 1733—1744.
- ↑ Gray R. D., Jr., Rent N. H. and Zudkevitch D. A modified Redlich — Kwong equation of state // The American Institute of Chemical Engineers Journal. — 1970. — В. 6. — Т. 16. — С. 991—998.
- ↑ Wilson G. M. // Advances in Cryogenic Engineering. — 1964. — Т. 9. — С. 168.
- ↑ Wilson G. M. // Advances in Cryogenic Engineering. — 1966. — Т. 11. — С. 392.
- ↑ Barnès F. J. Ph. D. thesis. Department of Chemical Engineering, University of California, Berkeley, 1973.
- ↑ King C. J. Personal communication, 1974.
- ↑ Soave G. Equilibrium constants from a modified Redlich — Kwong equation of state // Chemical Engineering Science. — 1972. — В. 6. — Т. 27. — С. 1197—1203.
- ↑ West E. W., Erbar J. H. An Evaluation of Four Methods of Predicting the Thermodynamic Properties of Light Hydrocarbon Systems // Paper presented at 52d Annual Meeting NGPA, Dallas, Tex., March 26—28. — 1972.
Wikimedia Foundation. 2010.
Уравнение состояния Редлиха — Уравнение состояния Стат … Википедия
Уравнение состояния Бенедикта — Вебба — Рубина — Уравнение состояния Статья является частью серии «Термодинамика». Уравнение состояния идеального газа … Википедия
Уравнение состояния Бенедикта — Уравнение состояния Стат … Википедия
Уравнение состояния Барнера — Адлера — Уравнение состояния Статья является частью серии «Термодинамика». Уравнение состояния идеального газа … Википедия
Уравнение состояния Ли — Эрбара — Эдмистера — Уравнение состояния Статья является частью серии «Термодинамика». Уравнение состояния идеального газа … Википедия
Уравнение состояния Суги — Лю — Уравнение состояния Статья является частью серии «Термодинамика». Уравнение состояния идеального газа Уравнен … Википедия
Уравнение состояния Барнера — Уравнение состояния Стат … Википедия
Уравнение состояния Ли — Уравнение состояния Стат … Википедия
Уравнение состояния Суги — Уравнение состояния Статья является час … Википедия
Уравнение состояния идеального газа — Уравнение состояния Стат … Википедия

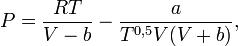
![a=\frac{1}{9\cdot(\sqrt[3]{2}-1)}\frac{R^2T^{2{,}5}_\mathrm{k}}{P_\mathrm{k}}\approx\frac{0{,}42748R^2T^{2{,}5}_\mathrm{k}}{P_\mathrm{k}},](http://dic.academic.ru/pictures/wiki/files/97/a0a1fe5fc4057905bbfbd183006ba7d1.png)
![b=\frac{\sqrt[3]{2}-1}{3}\frac{RT_\mathrm{k}}{P_\mathrm{k}}\approx\frac{0{,}08664RT_\mathrm{k}}{P_\mathrm{k}},](http://dic.academic.ru/pictures/wiki/files/56/8ad216d39b1be1c937cdc5fcfe89b694.png)
![\Delta Z=-0{,}04666626T^2_\mathrm{r}P^2_\mathrm{r}\exp[-7000(1-T_\mathrm{r})^2-770(1{,}02-P_\mathrm{r})^2]\,-](http://dic.academic.ru/pictures/wiki/files/52/47c95fb3baa6e7fa2fd2212082147cc0.png)
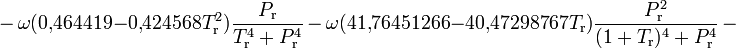
![-\,[0{,}11386032-\omega(12{,}55135462-12{,}5583112T_\mathrm{r})]\frac{P^3_\mathrm{r}}{(1+T_\mathrm{r})^4+P^4_\mathrm{r}},](http://dic.academic.ru/pictures/wiki/files/52/47253e214459ae3cad8918d18e3327d7.png)
![Z=\frac{V}{V-b}-\frac{1}{3(\sqrt[3]{2}-1)^2}\frac{b}{V+b}F(\omega,\;T_\mathrm{r}),](http://dic.academic.ru/pictures/wiki/files/53/58f8c18a41ea72defd2c8193897f153d.png)
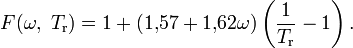
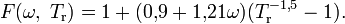
![F(\omega,\;T_\mathrm{r})=\frac{1}{T_\mathrm{r}}[1+(0{,}480+1{,}574\omega-0{,}176\omega^2)(1-T^{0{,}5}_\mathrm{r})]^2.](http://dic.academic.ru/pictures/wiki/files/102/f90f101ee90a1c55d38f6b869696aa65.png)