- Оксид азота(IV)
-
Оксид азота(IV) 
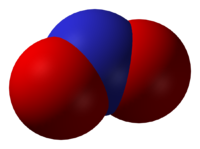
Общие Систематическое наименование Оксид азота(IV) Химическая формула NO2 Физические свойства Состояние (ст. усл.) бурый газ или желтоватая жидкость Молярная масса 46,0055 г/моль Плотность г. 2,0527 г/л
ж. 1,4910г/см³
тв. 1,536 г/см³Термические свойства Температура плавления -11,2 °C Температура кипения 21,1 °C Энтальпия образования (ст. усл.) 33,10 кДж/моль Классификация Рег. номер CAS 10102-44-0 Оксид азота (IV) (диоксид азота, бурый газ) NO2 — газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона. При температуре 140 °C диоксид азота состоит только из молекул NO2, он очень тёмного, почти чёрного цвета. В точке кипения NO2 представляет собой желтоватую жидкость, содержащую около 0,1 % NO2. При температуре ниже 21°С — это бесцветная жидкость (или желтоватая из-за примеси мономера). При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
Содержание
Получение
В лаборатории NO2 обычно получают воздействием концентрированной азотной кислотой на медь:
Также его можно получить термическим разложением нитрата свинца, однако при проведении реакции следует соблюдать осторожность:
Химические свойства
Кислотный оксид, ему соответствуют азотная и азотистая кислоты. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель:
Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты:
При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
Поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются HNO3 и NO:Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):
При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
Жидкий NO2 применяется для получения безводных нитратов:
Применение
В производстве серной и азотной кислот, в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
Физиологическое действие
Оксид азота (IV) высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
«Лисий хвост»
«Лисий хвост» — жаргонное название выбросов в атмосферу оксидов азота на химических предприятиях (иногда — из выхлопных труб автомобилей). Название происходит от оранжево-бурого цвета диоксида азота. При низких температурах диоксид азота димеризуется и становится бесцветным. В летний сезон «лисьи хвосты» наиболее заметны, так как в выбросах возрастает концентрация мономерной формы.
Вредное воздействие
Оксиды азота, улетучивающиеся в атмосферу, представляют серьёзную опасность для экологической ситуации, так как способны вызывать кислотные дожди, а также сами по себе являются токсичными веществами, вызывающими раздражение слизистых оболочек.
Двуокись азота воздействует в основном на дыхательные пути и легкие, а также вызывает изменения состава крови, в частности, уменьшает содержание в крови гемоглобина.
В специальной литературе также указывается на то, что воздействие на организм человека диоксида азота снижает сопротивляемость к заболеваниям, вызывает кислородное голодание тканей, особенно у детей. Усиливает действие канцерогенных веществ, способствуя возникновению злокачественных новообразований.
Образующаяся в результате взаимодействия диоксида азота с водой азотная кислота является сильным коррозионным агентом.
Для улучшения этой статьи желательно?: - Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.

Оксиды азота  Оксид азота(I) (N2O)
Оксид азота(I) (N2O) Оксид азота(II) (NO)
Оксид азота(II) (NO) Оксид азота(III) (N2O3)
Оксид азота(III) (N2O3) Оксид азота(IV) (NO2)
Оксид азота(IV) (NO2) Оксид азота(V) (N2O5)Категория:
Оксид азота(V) (N2O5)Категория:- Оксиды азота
-
Wikimedia Foundation. 2010.












