- Фторид иода(VII)
-
Фторид иода(VII) 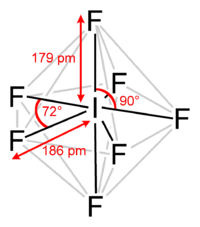
Общие Систематическое наименование Фторид иода (VII) Химическая формула IF7 Физические свойства Отн. молек. масса 260 а. е. м. Молярная масса 259,89 г/моль Плотность 2,7 г/см³ Термические свойства Температура плавления 4,5 °C Температура кипения 4,77 °C Температура разложения 350 °C Классификация Рег. номер CAS 16921-96-3 Фторид иода(VII) (гептафторид иода), IF7 — бесцветное газообразное вещество (при 20 °C) с резким запахом, высший фторид иода, в котором атом иода проявляет степень окисления +7.
Содержание
Физическо-химические свойства
До сегодняшнего дня нет единого мнения о температурах фазового перехода соединения, поскольку его сложно отчистить от примеси IOF5, который занижает температуру плавления. По некоторым данным, температура плавления соединения находится в пределах 6,4 ± 0,1°С[1].
Свойство Значение[2] Энтальпия образования (298 К, в газовой фазе) −122,22 кДж/моль(по другим данным[3] −229,80 кДж/моль) Энтропия образования (300 К, в газовой фазе) 355,16 Дж/(моль·К) Теплоёмкость (300 К, в газовой фазе) 137,09 Дж/(моль·К) Строение
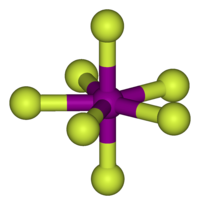
Пентагонально-бипирамидальное строение молекулы подтверждено спектроскопически при помощи ИК, КР и ЯМР-19F спектроскопии.
Методы получения
- Известен метод получения гептафторида взаимодействием иода с фторидами металлов, например, фторидом серебра. Такую реакцию впервые наблюдал Каммерер. Однако, в таких условиях также получается пентафторид иода:
- Также применяется метод получения из простых веществ. Для этого фтор пропускают над иодом в платиновом реакторе. Сначала образуется пентафторид иода, который при 270 °C реагирует с фтором и образуется гептафторид.
- Чаще всего применяют взаимодействие пентафторида иода с фтором, при этом проходят процессы аналогичные второй стадии предыдущего метода.
- Продукт, полученный вышеописанными методами, всегда загрязнён примесью IOF5 за счёт гидролиза IF5. Поэтому, для получения чистого продукта можно применять метод взаимодействия фтора с сухими иодидами[1]. Например:
Химические свойства
Химические свойства гептафторида иода во многом схожи со свойствами трифторида хлора. Химически чрезвычайно активен и агрессивен к большинству материалов. Сильный окислитель.
- Достаточно часто, в начале реакции молекула гептафторида отщепляет 2 атома фтора, которые участвуют в дальнейшей реакции, а IF5 выделяется с продуктами:
- Углекислый газ сгорает в присутствии IF7 с образованием простого иода:
- Гидролизуется водой, при этом образуется ортоиодная кислота и фтороводород:[4]
- Реагирует с диоксидом кремния и стеклом с образованием оксопентафторида иода и тетрафторида кремния:
- С некоторыми фторидами (AsF5, SbF5, BF3)[5] образует комплексные соединения, которые вполне устойчивы до температуры около 140 °C. Предположительно, структура таких соединений ионная: IF6+·AsF6−.
- Органические соединения при контакте с гептафторидом иода воспламеняются с образованием массы различных продуктов, которые обычно не полностью идентифицированы.
Применение
Нашёл некоторое применение в органическом синтезе.[6]
Опасности
Гептафторид иода высокоопасен, очень сильно раздражает кожу и слизистые оболочки.
См. также
- Фтор
- Иод
- Фторид иода(I)
- Фторид иода(III)
- Фторид иода(V)
Литература
- Химия галоидных соединений фтора. Николаев Н. С., Сухоруков В. Ф., Шишков Ю. Д., Аленчикова И. Ф. — М.: Наука, 1968, с.344.
Примечания
- ↑ 1 2 англ. Bartlett, Levchuk, Proc. Chem. Soc., 1963, P.362
- ↑ англ. R.K. Khanna J. Mol. Spectr., 1962, V.8, P.134
- ↑ The enthalpies of formation of iodine pentafluoride and iodine heptafluoride. Journal of Inorganic and Nuclear Chemistry. V. 28, 1976, P. 135—140
- ↑ IF7 на сайте «Химия и токсикология»
- ↑ Acceptor properties of iodine heptafluoride: octafluoroperiodates(VII). Inorganic and Nuclear Chemistry Letters. V. 10, Issue 10, 1974, P. 831—835
- ↑ Успехи химии, 1984, Том 53, Номер 12, Страницы 2024—2055.
Соединения фтораГексафторалюминат натрия (Na3AlF6) • Гексафтороантимонат водорода (HSbF6) • Гексафторид платины (PtF6) • Гексафторид селена (SeF6) • Гексафторид теллура (TeF6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторогерманат рубидия (Rb2[GeF6]) • Гексафторогерманат цезия (Cs2[GeF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторосиликат натрия (Na2SiF6) • Гексафторплатинат ксенона (XePtF6) • Гексафторсиликат аммония ((NH4)2SiF6) • Гептафторид рения (ReF7) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрофторид аммония ([NH4][HF2]) • Гидрофторид калия (HF2K) • Декафторид дисеры (S2F10) • Диоксидифторид (F2O2) • Диоксидифторид молибдена(VI) (MoF2O2) • Дифтордиазин (N2F2) • Дифторид радона (F2Rn) • Кремнефтористоводородная кислота (H2SiF6) • Монофторид алюминия (AlF) • Монофторид углерода (CF) • Оксид-фторид урана (UO2F2) • Окситетрафторид вольфрама(VI) (WOF4) • Окситетрафторид молибдена(VI) (MoOF4) • Оксифторид иттрия (YOF) • Оксифторид лантана(III) (LaOF) • Оксотетрафторид ксенона (XeOF4) • Оксотрифторид ванадия(V) (F3OV) • Пентафторид висмута (BiF5) • Пентафторид мышьяка (AsF5) • Пентафторид сурьмы (SbF5) • Пентафторид урана (UF5) • Пентафторид фосфора (PF5) • Субфторид серебра (Ag2F) • Тетрафторалюминат калия (KAlF4) • Тетрафтороборат лития (LiBF4) • Тетрафтороборат меди(II) (Cu(BF4)2) • Тетрафтороборат натрия (NaBF4) • Тетрафтороборат нитрозила (BF4NO) • Тетрафтороборат нитрония (BNO2F4) • Тетрафтороборат серебра (AgBF4) • Тетрафторборная кислота (HBF4) • Тетрафторид дибора (B2F4) • Тетрафторид кремния (SiF4) • Тетрафторид селена (SeF4) • Тетрафторид теллура (TeF4) • Тетрафторгидразин (N2F4) • Трифторид алюминия (AlF3) • Трифторид бора (BF3) • Трифторид мышьяка (AsF3) • Трифторид висмута (BiF3) • Трифторид сурьмы (SbF3) • Трифторид тиазила (NSF3) • Трифторид фосфора (PF3) • Фторфосфат натрия (Na2PFO3) • Фторамин (NH2F) • Фторид азота(III) (NF3) • Фторид аммония (NH4F) • Фторид бария (BaF2) • Фторид бериллия (BeF2) • Фторид брома(I) (BrF) • Фторид брома(III) (BrF3) • Фторид брома(V) (BrF5) • Фторид ванадия(III) (VF3) • Фторид ванадия(IV) (VF4) • Фторид ванадия(V) (VF5) • Фторид вольфрама(VI) (WF6) • Фторид галлия(III) (GaF3) • Фторид гафния(IV) (HfF4) • Фторид дейтерия (DF) • Фторид диртути(2+) (Hg2F2) • Фторид железа(II) (FeF2) • Фторид железа(III) (FeF3) • Фторид золота(III) (AuF3) • Фторид золота(V) (AuF5) • Фторид индия(III) (InF3) • Фторид иода(I) (IF) • Фторид иода(III) (IF3) • Фторид иода(V) (IF5) • Фторид иода(VII) (IF7) • Фторид иридия(IV) (IrF4) • Фторид иридия(V) (IrF5) • Фторид иридия(VI) (IrF6) • Фторид иттербия(III) (YbF3) • Фторид иттрия (YF3) • Фторид иттрия-лития (LiYF4) • Фторид кадмия (CdF2) • Фторид калия (KF) • Фторид кальция (CaF2) • Фторид кислорода(II) (OF2) • Фторид кобальта(II) (CoF2) • Фторид кобальта(III) (CoF3) • Фторид криптона(II) (KrF2) • Фторид ксенона(II) (XeF2) • Фторид ксенона(IV) (XeF4) • Фторид ксенона(VI) (XeF6) • Фторид лития (LiF) • Фторид магния (MgF2) • Фторид марганца(II) (MnF2) • Фторид марганца(III) (MnF3) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Фторид молибдена(VI) (MoF6) • Фторид натрия (NaF) • Фторид никеля(II) (NiF2) • Фторид ниобия(V) (NbF5) • Фторид нитрозила) (NOF) • Фторид оксида азота(IV) (NO2F) • Фторид оксида серы(IV) (SO2F2) • Фторид олова(II) (SnF2) • Фторид олова(IV) (SnF4) • Фторид плутония(III) (PuF3) • Фторид плутония(IV) (PuF4) • Фторид плутония(VI) (PuF6) • Фторид радия (RaF2) • Фторид рения(IV) (ReF4) • Фторид рения(VI) (ReF6) • Фторид рения(VII) (ReF7) • Фторид ртути(II) (HgF2) • Фторид рубидия (RbF) • Фторид самария(III) (SmF3) • Фторид свинца(II) (PbF2) • Фторид серебра(I) (AgF) • Фторид серебра(II) (AgF2) • Фторид серы(IV) (SF4) • Фторид серы(VI) (SF6) • Фторид скандия(III) (ScF3) • Фторид стронция (SrF2) • Фторид таллия(I) (TlF) • Фторид тантала(V) (TaF5) • Фторид теллура(IV) (TeF4) • Фторид технеция(VI) (TcF6) • Фторид тиазила (NSF) • Фторид тианила (SOF2) • Фторид титана(III) (TiF3) • Фторид титана(IV) (TiF4) • Фторид тория(IV) (ThF4) • Фторид урана(III) (UF3) • Фторид урана(IV) (UF4) • Фторид урана(V) (UF5) • Фторид урана(VI) (UF6) • Фторид хлора(I) (ClF) • Фторид хлора(III) (ClF3) • Фторид хлора(V) (ClF5) • Фторид хрома(III) (CrF3) • Фторид хрома(IV) (CrF4) • Фторид хрома(V) (CrF5) • Фторид цезия (CsF) • Фторид цинка (ZnF2) • Фторид циркония(IV) (ZrF4) • Фторид-хлорид оксида серы(IV) (ClFO2S) • Фторноватистая кислота (HOF) • Фтороводород (HF) • Фторосульфоновая кислота (FSO3H) • Фторид хлорила (ClO2F) • Фторид перхлорила (ClO3F) • Фторид оксиперхлорила (ClO3OF)
Категории:- Фториды
- Межгалоидные соединения
- Соединения иода
Wikimedia Foundation. 2010.









![\mathsf{IF_7 + AsF_5 \rightarrow IF_6[AsF_6]}](d63d5419ce8d7f7d666b79d772f8b24b.png)