- Бромид меди(I)
-
Бромид меди(I) 
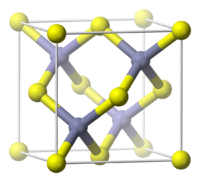
Общие Систематическое наименование Бромид меди(I) Традиционные названия бромистая медь Химическая формула CuBr Физические свойства Состояние (ст. усл.) твёрдое Молярная масса 143,45 г/моль Плотность 4,72 г/см³ Термические свойства Температура плавления 504 °C Температура кипения 1350 °C Молярная теплоёмкость (ст. усл.) 71,9 Дж/(моль·К) Энтальпия образования (ст. усл.) в газовой фазе: 120 кДж/моль;
в твёрдой фазе: −105 кДж/мольХимические свойства Растворимость в воде 1,2·10−3 г/100 мл Оптические свойства Показатель преломления 2,09 Классификация Рег. номер CAS 7787-70-4 Броми́д ме́ди(I) — неорганическое вещество с формулой CuBr, соединение меди и брома. Относится к классу бинарных соединений, может рассматриваться как соль одновалентной меди и бромоводородной кислоты. В чистом виде — белое кристаллическое вещество, примеси бромида меди(II) окрашивают его в зеленоватый цвет.
Содержание
Физические свойства
В чистом виде представляет собой бесцветные тетраэдрические микрокристаллы. Кристаллическая решетка типа сфалерита (кубическая сингония).
Во влажном воздухе на свету медленно окисляется, приобретая зеленоватый цвет. Термически устойчив: плавится и кипит без разложения. Нерастворим в воде, этаноле, эфире. Не образует кристаллогидраты.[1]
Химические свойства
Образование растворимых соединений
Бромид меди(I) растворяется в горячей концентрированной серной кислоте:
За счет комплексообразования растворяется в концентрированных растворах бромоводородной кислоты, бромида калия, цианида калия, аммиака:
Прочие реакции
При кипячении водной суспензии бромида меди(I) происходит дисмутация последнего на бромид меди(II) и металлическую медь:
Бромид меди(I) медленно окисляется на свету во влажном воздухе:
Образует молекулярные аддукты с основаниями Льюиса, например с диметилсульфидом:
Получение
Бромид меди(I) можно получить одним из следующих способов.
Термическим разложением бромида меди(II):
Реакцией оксида меди(I) с разбавленной бромоводородной кислотой:
Восстановлением растворимых солей двухвалентной меди диоксидом серы в присутствии растворимых бромидов, например:
Пропусканием газообразного бромоводорода через суспензию металлической меди в эфире с последующим разложением образовавшегося дибромокупрата(I) водорода:
Восстановлением растворимых солей двухвалентной меди металлической медью в присутствии бромида калия с последующим разложением образовавшегося дибромокупрата(I) калия:
Применение
Бромид меди(I) применяется в органическом синтезе.
См. также
Примечания
- ↑ Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — С. 142. — 637 с. — ISBN 978-5-358-01303-2

Бромид меди(I) на Викискладе? Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Растворимость кислот, оснований и солей в водеH+ Li+ K+ Na+ NH4+ Ba2+ Ca2+ Mg2+ Sr2+ Al3+ Cr3+ Fe2+ Fe3+ Ni2+ Co2+ Mn2+ Zn2+ Ag+ Hg2+ Hg22+ Pb2+ Sn2+ Cu+ Cu2+ OH− P P P — P М Н М Н Н Н — Н Н Н Н Н — — Н Н Н Н F− P Н P P Р М Н Н М Р Н Н Н Р Р М Р Р М М Н Р Н Р Cl− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Н М — Н Р Br− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Н М Н М Р H Р I− P P P P Р Р Р Р Р Р ? Р — Р Р Р Р Н Н Н Н М Н — S2− P P P P — Р М Н Р — — Н — Н Н Н Н Н Н Н Н Н Н Н SO32− P P P P Р М М М Н ? ? М ? Н Н Н М Н Н Н Н ? Н ? SO42− P P P P Р Н М Р Н Р Р Р Р Р Р Р Р М — Н Н Р Р Р NO3− P P P P Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р — Р — Р Р NO2− P P P P Р Р Р Р Р ? ? ? ? Р М ? ? М ? ? ? ? ? ? PO43− P Н P P — Н Н Н Н Н Н Н Н Н Н Н Н Н Н ? Н Н Н Н CO32− М Р P P Р Н Н Н Н — — Н — Н Н — Н Н — Н — — ? — CH3COO− P Р P P Р Р Р Р Р — Р Р — Р Р Р Р Р Р М Р — Р Р CN− P Р P P Р Р Р Р Р ? Н Н — Н Н Н Н Н Р Н Р — — Н SiO32− H Н P P ? Н Н Н Н ? ? Н ? ? ? Н Н ? ? ? Н ? ? ? Соединения медиАзид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодады меди(II) • Полииодиды меди(II) (CuIn) • Роданид меди(I) (CuSCN) • Роданид меди(II) (Cu(SCN)2) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) •
Соединения бромаБромат калия (KBrO3) • Бромат кальция (Ca(BrO3)2) • Бромат натрия (NaBrO3) • Бромат серебра (AgBrO3) • Бромат стронция (Sr(BrO3)2) • Броматы • Бромид алюминия (AlBr3) • Бромид бора(III) (BBr3) • Бромид диртути(2+) (Hg2Br2) • Бромид магния (MgBr2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромиды • Бромистая кислота (HBrO2) • Бромистоводородная кислота (HBr) • Бромная кислота (HBrO4) • Бромноватая кислота (HBrO3) • Бромноватистая кислота (HBrO) • Бромопентакарбонилрений(I) (Re(CO)5Br) • Броморганические соединения • Гипобромистая кислота (HOBr) • Диоксид брома (BrO2) • Оксид брома (Br2O) • Пербромат калия (KBrO4) • Фторид брома(I) (BrF) • Фторид брома(III) (BrF3) • Фторид брома(V) (BrF5) • Хлорид брома (BrCl)
 Категории:
Категории:- Соединения меди
- Бромиды
- Бинарные соединения
- Галогениды металлов
Wikimedia Foundation. 2010.


![\mathsf{CuBr + MBr \longrightarrow \ M[CuBr_2], \ (M=H,K)}](80d8ebd90cfb1302f028667178afd573.png)
![\mathsf{CuBr + 2KCN \longrightarrow \ K[Cu(CN)_2] +KBr}](d5dc0c4a6e9a601957c23a45e154c149.png)
![\mathsf{CuBr + 2(NH_3 \cdot H_2O) \longrightarrow \ [Cu(NH_3)_2]Br + 2H_2O}](191e39e3214ed5883b39816a8c3be67d.png)







![~\mathsf{2Cu+4HBr \longrightarrow 2H[CuBr_2]+H_2 \uparrow}](bbdcc603191d6e0e21fef8b4470c8828.png)
![~\mathsf{H[CuBr_2] \longrightarrow CuBr+HBr}](2529640b8d4a24485c95b6e3a975e79a.png)
![~\mathsf{CuSO_4+4KBr+Cu \ \longrightarrow \ 2K[CuBr_2]+K_2SO_4}](4917e7374ba85cb4688e09cb03f416cc.png)
![~\mathsf{K[CuBr_2] \ \longrightarrow \ CuBr+KBr}](f29d9c4ae9ab2a2c2761d1e420188b6a.png)